銅離子載體誘導的細胞死亡研究及應用
圖 1. 不同死亡方式的比較
"鐵死亡"的相關研究更是近幾年熱點中的“熱點“,這也證明了金屬元素在細胞死亡中的獨特作用。迎來鐵死亡,又遇銅死亡。
今年 3 月題為 Copper induced cell death by targeting lipoylated TCA cycle protein 一文提出:生物體內不可缺少的微量元素—銅在其濃度超過了維持穩態機制的閾值時也會表現出細胞毒性。這種現象與鐵積累導致細胞死亡的情況有相似之處 (但機制明顯區別于鐵死亡)。研究人員將這種銅離子誘導細胞死亡的機制命名為 “銅死亡” (Cuproptosis)。
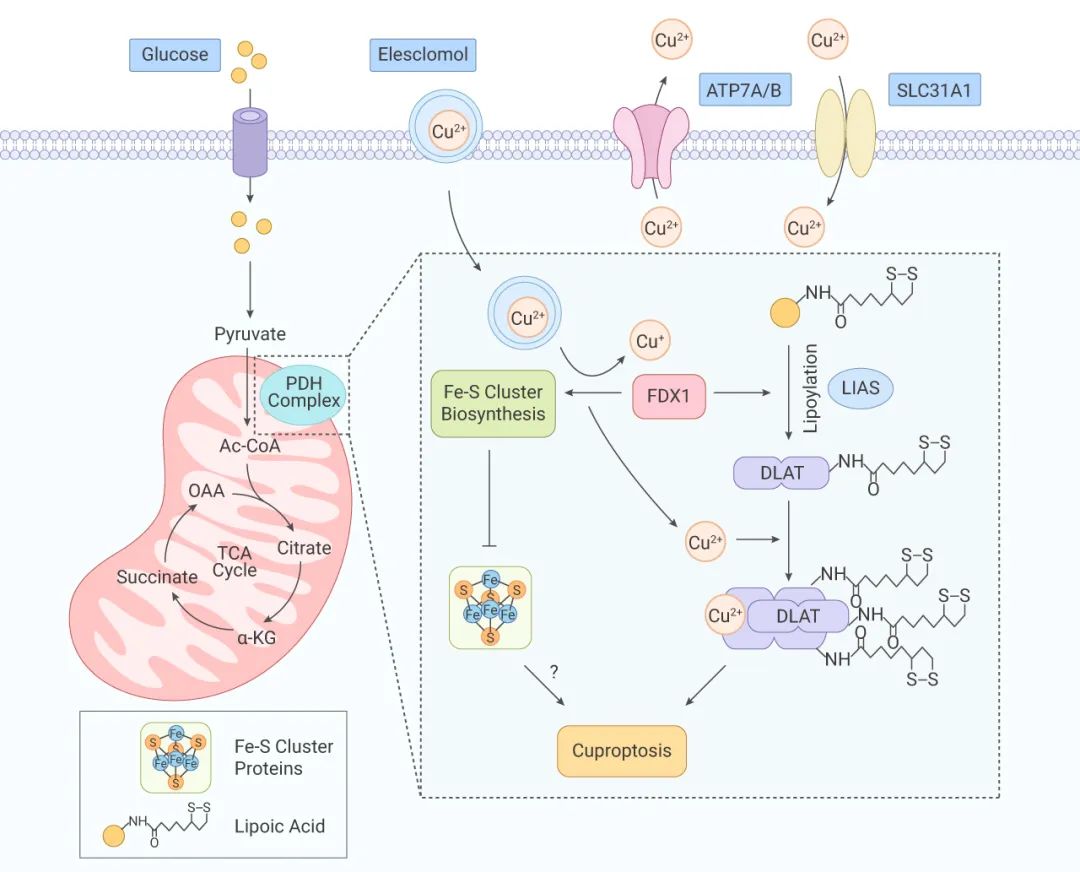
■ 銅死亡的簡要機制
銅離子載體誘導的細胞死亡: 當 Cu2+ 在依賴線粒體呼吸的細胞中過度積累 (Cu2+ 通過銅離子載體運入細胞),Cu2+ 與硫辛酰化 DLAT 結合,誘導 DLAT 的異聚化。不溶性 DLAT 的增加導致細胞毒性,誘導細胞死亡。
注:蛋白質硫辛酰化修飾是一種保守的賴氨酸翻譯后修飾,只發生在涉及 TCA 循環的四種蛋白,其中就包括 DLAT。DLAT 是丙酮酸脫氫酶復合體 (PDH Complex) 組分之一,丙酮酸脫氫酶可催化 TCA 循環中的丙酮酸脫羧生成乙酰輔酶 A。
FDX1 (一種還原酶、Elesclomol 的直接靶標) 作為蛋白質硫辛酰化修飾的上游調節因子,一方面,參與調節蛋白質 (包括 DLAT) 的硫辛酰化。另一方面,FDX1 將 Cu2+ 還原成更具毒性的 Cu+,導致 Fe-S 簇蛋白合成的抑制,誘導細胞死亡。
銅穩態失調導致的細胞死亡: 銅的穩態主要依賴與三個銅轉運蛋白 SLC31A1、ATP7A/B、SLC31A1,SLC31A1 負責攝入銅,ATP7A 和 ATP7B 負責轉出銅。銅穩態失調導致的細胞死亡與銅離子載體誘導的細胞死亡的機制一致。
■ 銅離子載體誘導的細胞死亡
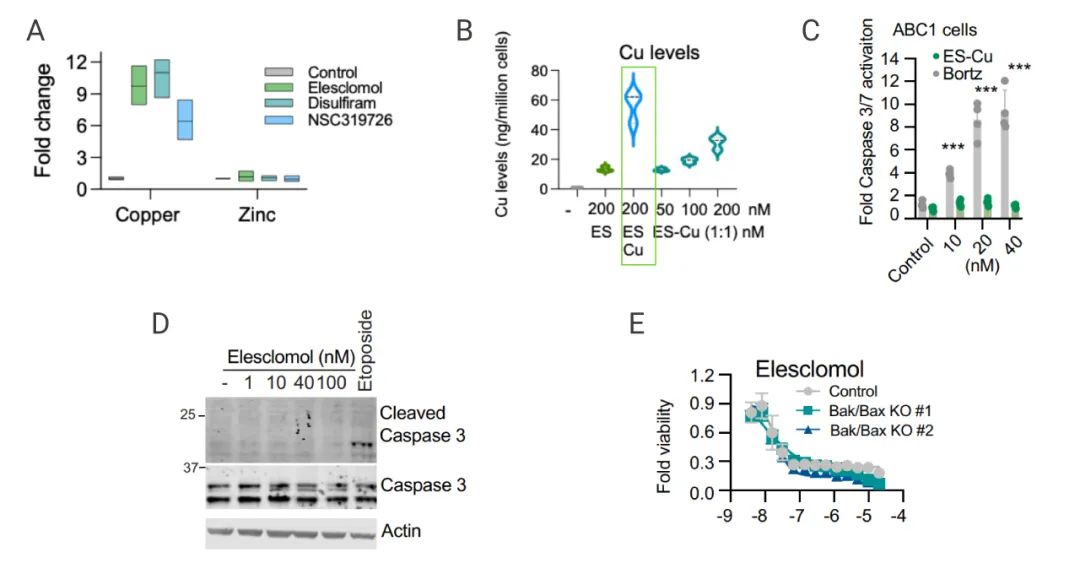
在這篇文章中,研究人員測試了 1448 個銅離子載體 (一種高度親脂性的 Cu2+ 結合分子,可將銅離子送入細胞),發現對 489 個細胞系的細胞殺傷作用 (圖 3A)。以 Elesclomol (一種高度親脂性的 Cu2+ 載體) 為例,單獨加入 Elesclomol 不影響細胞的生長,同時加入銅離子,細胞生長就會受到極大抑制,而其他金屬離子 (鐵、鈷、鋅和鎳等) 并不會影響細胞的生長 (圖 3B)。使用 NSC-319726,Disulfiram 等其它銅離子載體處理細胞也得到了相同的結果 (圖 3D-E)。
但使用 Tetrathiomolybdate (TTM;一種銅螯合劑) 聯合 Elesclomol 處理細胞,可以緩解 Elesclomol 對細胞的殺傷作用。這些結果表明銅離子載體誘導的細胞死亡主要依賴于細胞內銅的積累。
圖 3. 銅離子載體誘導的細胞死亡對銅具有高度選擇性[2]
A:1448 個銅離子載體對 489 個細胞系的生長抑制;B:不同金屬離子的情況下,用 Elesclomol 處理 MON 細胞;C:其他銅離子載體條件的細胞活力測定 D:使用 TTM 預處理 ABC1 細胞,然后 Elesclomol 處理
■ 銅離子載體誘導細胞死亡是非凋亡性的
有研究表明 Elesclomol 誘導活性氧依賴性細胞凋亡,但實驗結果表明 Elesclomol 誘導的細胞死亡不涉及 Caspase 3 (細胞凋亡的標志) 的切割或激活 (圖 4D-E)。并且當細胞凋亡的關鍵效應子 BAX 和 BAK1 被敲除時,以及用 Caspase 抑制劑 (Z-VAD-FMK 和 Boc-D-FMK) 處理細胞,Elesclomol 仍然維持對細胞的殺傷潛力,此外,其他已知細胞死亡機制的抑制劑處理細胞 (包括鐵死亡 (Ferrostatin-1)、壞死性凋亡 (Necrostatin-1) 和氧化應激 (N-acetylcysteine) ),也都未能消除銅離子載體誘導的細胞死亡。
這些結果表明銅離子載體誘導的細胞死亡機制與細胞凋亡途徑不同。
圖 4. 銅離子載體誘導細胞死亡不通過凋亡[2]
A:ICP-MS 檢測細胞內的銅離子和鋅離子;B:ES-Cu 處理 細胞,檢測 Caspase 3/7 的激活;C:檢測 Caspase 3 的表達;F:用 Elesclomol-CuCl2 處理 KO 細胞,檢測細胞活力;
■ 線粒體呼吸調節銅離子誘導細胞死亡
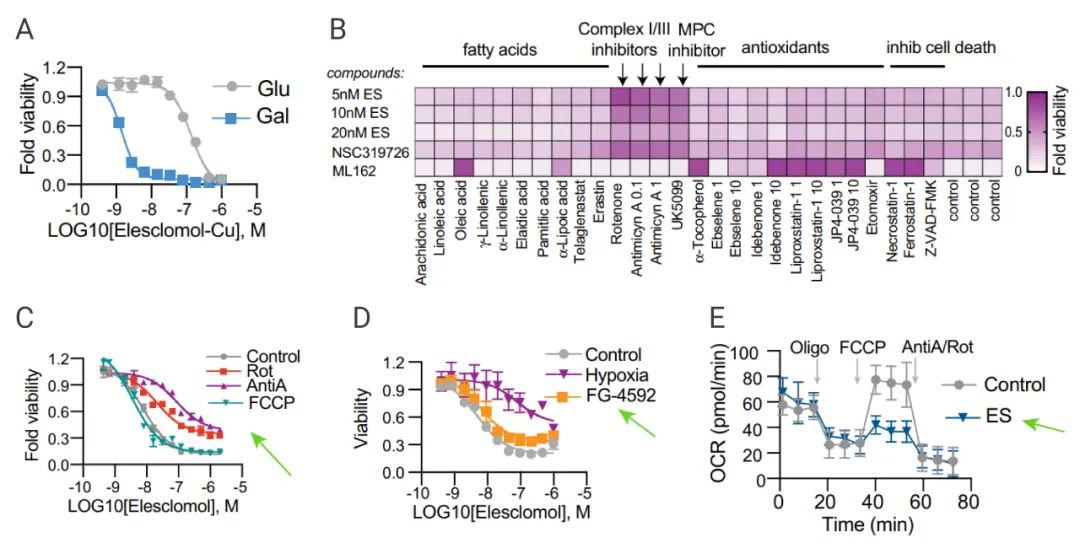
研究人員觀察到主要依賴線粒體呼吸的細胞對銅離子的敏感性更高 (圖 5A)。用線粒體抗氧化劑、脂肪酸和線粒體功能抑制劑等線粒體呼吸途徑相關的抑制劑處理細胞,發現:電子傳遞鏈復合物的抑制劑和線粒體丙酮酸攝取抑制劑 (UK5099) 處理的條件下,銅離子誘導的細胞死亡受抑制,鐵死亡抑制劑的處理對其沒有影響 (GPX4 抑制劑 ML162) (圖 5B)。
此外,線粒體氧化磷酸化解偶聯劑 FCCP 處理對銅離子誘導的細胞死亡沒有影響。這些結果表明線粒體呼吸途徑是銅離子載體誘導細胞死亡的必要條件。
研究人員還對比了缺氧條件刺激以及 FG-4592 激活缺氧誘導因子 (HIF) 途徑,發現只有真實缺氧條件會降低細胞對銅離子載體的敏感性 (圖 5D),進一步確認了線粒體呼吸在銅誘導細胞死亡中的關鍵作用。
隨后,研究人員分析銅離子處理對細胞耗氧率 (OCR) 的影響,結果顯示 Elesclomol 的處理會影響細胞的最大耗氧量 (圖 5E)。這表明銅離子可能不直接影響電子傳遞鏈,而是影響三羧酸循環 (TCA)。
A-B:葡萄糖或半乳糖的條件下,檢測細胞活力;B:Elesclomol 等處理細胞,檢測細胞活力;C:FCCP 預處理細胞后用 Elesclomol 處理,檢測細胞活力;D:對照組 (21% O2)、缺氧的條件 (1% O2) 或 FG-4592 (21% O2) 條件下檢測細胞活力;E:細胞耗氧率檢測
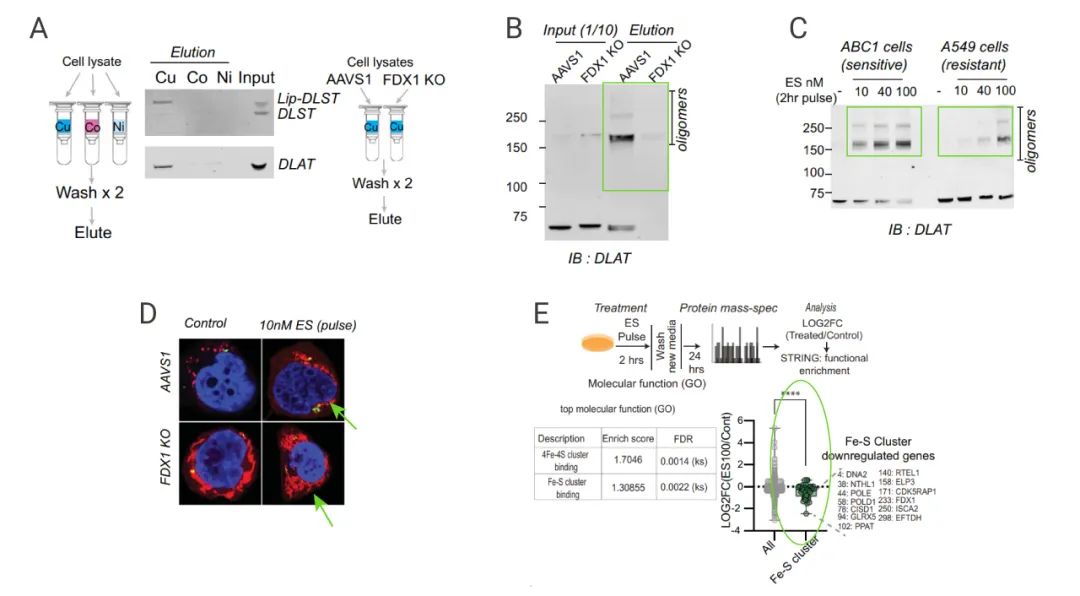
■ FDX1 和蛋白硫辛酰化是銅細胞誘導細胞死亡的關鍵調節者
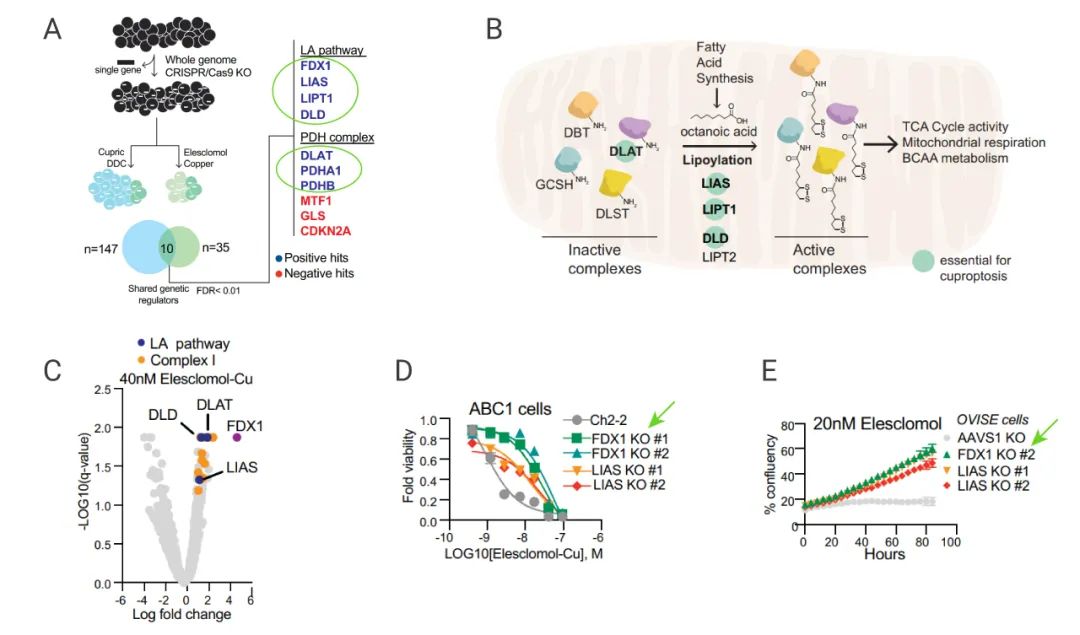
為進一步闡明銅離子和 TCA 循環之間的聯系。研究人員使用 CRISPR-Cas9 技術,分別敲除不同的基因,再使用銅離子載體 (Elesclomol-copper) 處理細胞,以確定涉及參與銅離子載體誘導細胞死亡的基因。
結果發現有 7 個基因的敲除可以明顯緩解銅離子載體介導的細胞殺傷作用 (圖 6A-C),包括 FDX1,LIPT1、LIAS、DLD (硫辛酸途徑的三個關鍵酶),DLAT、PDHA1、PDHB (丙酮酸脫氫酶復合體的三個組分)。另外,敲除 FDX1 和 LIAS 基因明顯減輕銅離子載體引起的細胞毒性(圖 6D-E),研究人員猜測 FDX1 有可能是蛋白質硫辛酰化修飾的上游調節因子。
A:敲除了不同基因后,細胞參與銅離子載體誘導的死亡的基因 B:硫辛酸通路的示意圖;C-E:敲除 ABC1 細胞的 FDX1 和 LIAS 基因,用 Elesclomol 處理細胞,檢測細胞活力。
為進一步驗證這個假設,研究人員通過資源庫 Cancer Dependency Map,發現 FDX1 和硫辛酸途徑相關蛋白在銅離子載體誘導細胞死亡方面是高度相關的 (圖 7A)。隨后,研究人員選取腫瘤樣本,對 FDX1 和硫辛酰化蛋白進行免疫組化染色,發現 FDX1 和硫辛酰化蛋白表達顯著相關 (圖 7B-C)。敲除 FDX1 會導致 DLAT 蛋白和 DLST 蛋白的硫辛酰化缺失 (圖 7D),還會導致細胞呼吸水平下降 (圖 7E)。
此外,研究人員通過代謝物分析發現敲除 FDX1 會導致丙酮酸和 α-酮戊二酸積累和琥珀酸的的消耗。還觀察到 LIAS 的關鍵底物 S-腺苷甲硫氨酸 (SAM) 的積累。這些結果表明 FDX1 是蛋白質硫辛酰化的上游調節劑 (圖 7F)。
A:FDX1 敲除的相關基因網絡;B-C:腫瘤樣本的 FDX1 和硫辛酸的免疫組化染色;D:敲除 FDX1,檢測硫辛酰化蛋白的表達量;E:敲除 FDX1 基因,檢測細胞耗氧率;F:敲除 FDX1,檢測與硫辛酰化途徑相關的代謝物的變化。
■ 銅直接結合并誘導硫辛酰化 DLAT 的寡聚化
有研究報道銅離子與游離脂酸的離解常數為 10–17,這表明銅離子有可能直接與硫辛酰化蛋白結合。為了驗證這一猜想,研究人員純化了 DLAT 和 DLST 蛋白,發現 DLAT 和 DLST 都可以與偶聯銅的樹脂結合 (圖 8A)。而敲除 FDX1 會導致 DLAT 蛋白的硫辛酰化修飾消失,且 DLAT 和 DLST 也不再與偶聯銅的樹脂結合 (圖 8B)。這表明蛋白質的硫辛酰化修飾是結合銅的必要條件。此外,銅與硫辛酰化蛋白 DLAT 的結合,會導致蛋白的寡聚化。而 Elesclomol 處理會增加 DLAT 蛋白的寡聚化 (圖 8C-D)。
上述結果表明:在銅離子載體處理后硫辛酰化蛋白的毒性是由它們異常的寡聚作用介導的。此外質譜分析還發現銅離子載體處理會導致 Fe-S 簇蛋白的水平降低 (圖 8E),這整個過程都依賴于 FDX1 蛋白的存在。
A:細胞提取蛋白和偶聯銅的樹脂的結合;B:FDX1 敲除細胞中提取蛋白和偶聯銅的樹脂的結合;C:IB 分析 DLAT 蛋白寡聚化;D: 免疫熒光共定位分析 E: Mass 分析
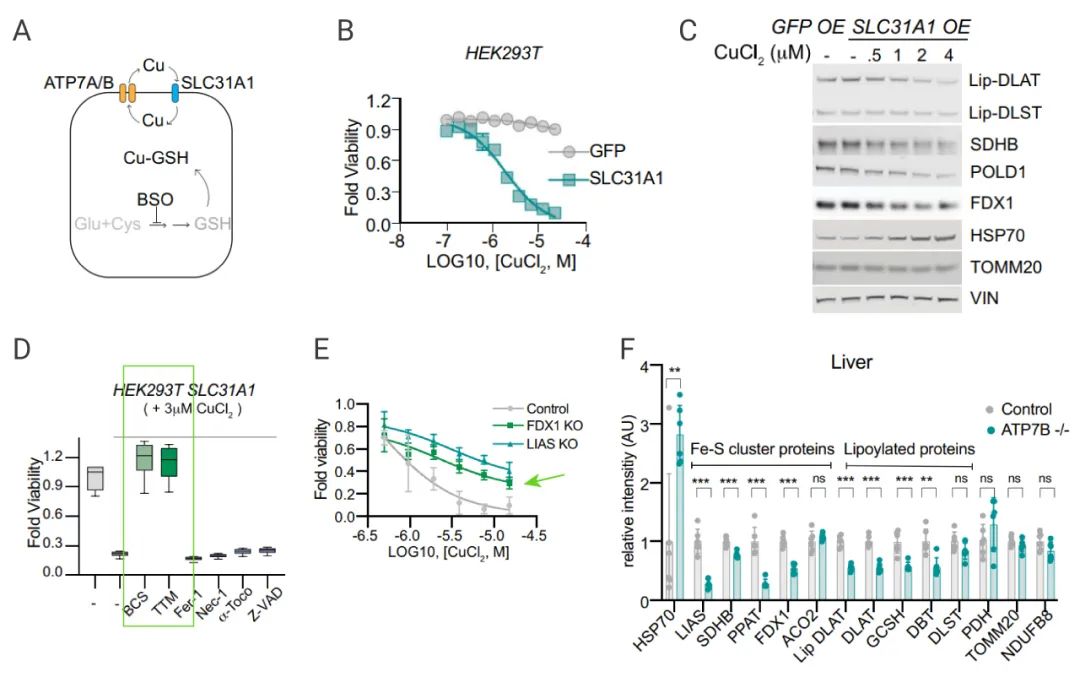
■ 銅誘導細胞死亡機制與銅穩態失調的遺傳模型相同
銅的穩態主要依賴與三個銅轉運蛋白 (圖 9A)。為了進一步驗證與銅離子載體介導的死亡與自然狀態下的銅紊亂的機制是否相同,研究人員過表達 SLC31A1(圖 9B)。另外,過表達 SLC31A1 的細胞被銅離子載體處理后蛋白硫辛酰化減少,Fe-S 簇蛋白水平降低,HSP70 水平升高 (圖 9C)。
在過表達 SLC31A1 的細胞中使用鐵死亡、壞死性凋亡和凋亡抑制劑不影響銅誘導的細胞死亡,銅螯合劑卻可緩解銅離子載體產生的細胞殺傷作用 (圖 9D)。老年 ATP7B 缺陷小鼠 (Atpb7b−/−,銅失調綜合征 Wilson’s disease 模型) 與雜合子 (Atpb7b+/−) 和野生型對照小鼠對比,發現 ATP7B 缺陷小鼠的肝臟中蛋白的硫辛酰化水平和 Fe-S 簇蛋白的含量均有顯著降低,Hsp70 蛋白則有明顯增加 (圖 9F)。多種模型證明銅穩態失調導致的細胞死亡和銅離子載體誘導的細胞死亡是同一種機制。
A:銅穩態示意圖;B-C:過表達SLC31A1,CuCl2 處理細胞;D:用 Nec-1 等處理過表達 SLC31A1 的細胞,加入 CuCl2,檢測細胞活力;E:FDX1 KO 細胞中過表達 SLC31A1,加入 CuCl2 處理后檢測細胞的活力;F:檢測 Atpb7b-/- 小鼠與對照組肝臟的蛋白質含量
總結:
這項研究通過利用多種死亡方式的誘導劑與抑制劑從多維度闡明了銅離子誘導的細胞死亡是一種新型細胞死亡即銅死亡。研究人員發現銅離子積累主要通過調控 FDX1 來介導銅死亡。
一方面,FDX1 將 Cu2+ 還原成更具毒性的 Cu+,可促使 TCA 循環中硫辛酰化蛋白異常寡聚化,另一方面,FDX1 導致 Fe-S 簇蛋白的不穩定。
|
相關產品 |
|
ML162 是一種共價谷胱甘肽過氧化物酶 4 (GPX4) 抑制劑。ML162 對表達突變 RAS 癌基因的細胞系具有選擇性的致死作用。 |
|
FCCP 是線粒體中氧化磷酸化 (OXPHOS) 解偶聯劑。 |
|
Ferrostatin-1 是一種選擇性的 ferroptosis 抑制劑,抑制 Erastin 誘導的細胞鐵死亡。 |
|
DL-Buthionine-(S,R)-sulfoximine DL-Buthionine-(S,R)-sulfoximine (BSO) 是谷氨酰半胱氨酸合成酶生物合成的有效抑制劑。 |
|
DPQ 是一種有效的 PARP-1 抑制劑,可降低 N-甲基-D-天冬氨酸 (NMDA) 誘導的 PARP 激活。 |
|
Elesclomol (STA-4783) 是一種氧化應激誘導劑,可誘導癌細胞凋亡。Elesclomol 還是一種高度親脂性的 Cu2+ 結合分子,可用于 Menkes 和遺傳性銅缺乏癥相關疾病的研究。 |
|
Boc-D-FMK 是不可逆的泛半胱天冬酶 (Caspase) 抑制劑,還可以抑制 TNF-α 誘導的細胞凋亡。 |
|
Roxadustat (FG-4592) 是一種低氧誘導因子脯氨酰羥化酶 (HIF-PHI) 抑制劑。 |
|
Etoposide 抑制拓撲異構酶 II (topoisomerase-II),誘導細胞周期停滯,誘導凋亡和自噬。 |
|
UK-5099 (PF-1005023) 是線粒體丙酮酸轉運蛋白 (MPC) 的有效抑制劑,抑制丙酮酸依賴性 O2 消耗。 |
|
Necrostatin-1 (Nec-1) 是一種有效的壞死性凋亡抑制劑。 |
|
Z-VAD-FMK 是一種泛半胱天冬酶 (Caspase) 抑制劑。 |
|
NSC319726 是突變型 p53R175 再活化劑,能抑制表達 p53R175 的成纖維細胞增殖,對野生型 p53 細胞無抑制作用。 |
|
Paclitaxel 可穩定微管蛋白的聚合,可導致有絲分裂停滯和誘導細胞凋亡,最終導致細胞死亡。 |
|
Acetylcysteine (N-acetylcysteine) 是一種活性氧抑制劑。Acetylcysteine 是半胱氨酸前體,通過中和花生四烯酸依賴的 5-脂氧合酶活性所產生的毒性脂質來防止血紅素誘導的鐵中毒。 |
|
Disulfiram 是特異性的乙醛脫氫酶 1 型抗體 (ALDH1) 抑制劑。Disulfiram 有效抑制人體和小鼠細胞中脂質體中的 GSDMD 孔形成,炎性體介導的細胞凋亡和 IL-1β 分泌。 |
|
8-Hydroxyquinoline (8-HQ) 是單質子二齒螯合劑,可用作防腐劑,消毒劑和殺蟲劑,用作轉錄抑制劑。 |
|
Pyrithione 是一種鋅離子載體,可引起哺乳動物細胞內鋅水平的升高。Pyrithione 具有有效的殺菌和抗真菌活性。 |
|
Rotenone 是線粒體電子傳遞鏈復合物I抑制劑。Rotenone 通過促進線粒體活性氧的產生來誘導細胞凋亡。 |
|
Oligomycin 是一種抗真菌抗生素,是 H+-ATP 合成酶的抑制劑。Oligomycin 阻斷氧化磷酸化和電子傳遞鏈。 |
|
Pepstatin (Pepstatin A) 是由放線菌類產生的一種特異性的天冬氨酸蛋白酶抑制劑。 |
MCE 的所有產品僅用作科學研究或藥證申報,我們不為任何個人用途提供產品和服務。
參考文獻
1. Yongqiang Wang, Long Zhang, Fangfang Zhou. Cuproptosis: a new form of programmed cell death. Cell Mol Immunol. 2022 Apr 22.
2. Tsvetkov P, Coy S, Petrova B, et al. Copper induces cell death by targeting lipoylated TCA cycle proteins. Science. 2022;375(6586):1254-1261.
3. Li SR, Bu LL, Cai L. Cuproptosis: lipoylated TCA cycle proteins-mediated novel cell death pathway. Signal Transduct Target Ther. 2022;7(1):158.4. Tang D, Chen X, Kroemer G. Cuproptosis: a copper-triggered modality of mitochondrial cell death. Cell Res. 2022;32(5):417-418.