熱原與內毒素的分子機理及其在藥物生產過程中的作用
熱原-從皮下注射用針頭說起
注射針頭的發明提供了一種新的給藥方式,但是早期的藥物注射由于種種原因并不安全,經常伴隨感染、不良反應、不明原因發燒甚至休克死亡。在19世紀下半葉,人們發現藥物注射是導致體溫異常升高的原因之一,但是具體機理并不清楚,因此這種“致熱因子”導致的疾病被描述為“注射熱”。
如今,大家對致熱原的來源、分子機理越來越清晰,控制和檢測越來越常規化,注射藥物也越來越安全。引起恒溫動物體溫異常升高的致熱物質,稱為“熱原”,從來源看包括細菌性熱原、內源性高分子熱原、內源性低分子熱原及化學熱原等,從成分上看有細菌內毒素、脂質膽酸、CpGDNA、鞭毛蛋白和其他非內毒素熱原(NEPs)。
熱原與內毒素
致熱能力最強的“熱原”是革蘭氏陰性桿菌的產物,其次是革蘭陽性桿菌類,革蘭陽性球菌則較弱,霉菌、酵母菌、甚至病毒也能產生熱原。大腸桿菌、銅綠假單胞菌等死亡或自溶后,游離脂多糖(LPS)可以從細胞表面或從制藥用水系統生成的生物膜釋放出來,或者從原料進入制藥用水或無菌系統。由于這種物質不是細菌分泌到體外的毒素(外毒素,如破傷風毒素),而是不被分泌的“存在于細菌體內的毒素”,所以又被稱為內毒素。LPS由三部分組成:類脂A、核心多糖、O-抗原。類脂A部分致熱作用最強,在LPS的生理活性表現中被認為起到最重要作用。
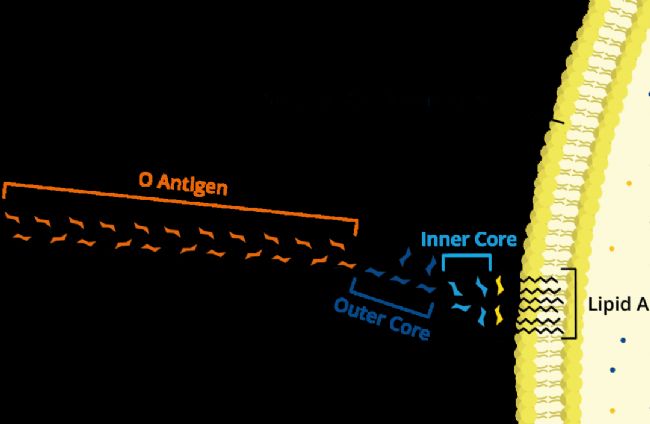 內毒素LPS分子結構示意圖
內毒素LPS分子結構示意圖
“嚴格地講,不是每一種熱原都是具有脂多糖結構,但是所有已知的細菌內毒素脂多糖都有熱原活性”。在藥品生產質量管理控制GMP條件下,藥品生產的質量控制一般可以接受的觀點是:不存在細菌內毒素意味著不存在熱原。內毒素只是熱原的一種類型。
在藥物生產過程中,熱原可以通過原料、溶劑、容器具帶入,制備過程中污染,滅菌不徹底或包裝不嚴也產生熱原。因此生產實踐中除了原料內毒素控制外,還得在制藥用水、生產過程中以及產品放行中廣泛進行內毒素監控,以保證用藥安全。
熱原的特點非常明顯:耐熱,注射劑通常滅菌的條件下,往往不足以破壞熱原,一般在250℃加熱30分鐘以上才能失活;兩極性;吸附性;能被強酸、強堿、強氧化劑及超聲波破壞等。藥品生產中必須兩方面進行控制,防止熱原污染和污染之后設法除,檢測顯得尤其重要。
內毒素檢測基本上只針對注射劑和醫療器械
人類與微生物世界處于一個共存的環境,健康的人也是大量微生物的宿主。但是人類在進化過程中建立了天然防御系統(如皮膚和消化道),可以將微生物及其代謝物(毒素等)限制在可以耐受的范圍。但注射給藥或醫療器械(如醫用輸液、輸血、注射器、植入器械等)使得熱原(如果存在)會繞過正常的身體防御,而直接進入血液循環系統,免疫系統對熱原如LPS產生免疫應答,信號通路觸發和級聯反應,釋放多種具有抗菌抗炎作用的細胞因子和趨化因子,作用于體溫調節中樞引起發熱,嚴重時能導致多臟器損傷。細菌內毒素主要針對注射劑,口服制劑和外用藥物制劑一般不做內毒素檢測。
內毒素導致“發熱”的分子機理
制藥行業內大家通常會把“內毒素”和“熱原”通用,用內毒素檢測替代熱原檢測,來監測生物制品的安全性。內毒素對宿主產生的影響是全身性的(如發燒),而不是像大多數外毒素那樣嚴格意義上的神經學影響。內毒素對人的急性毒性相對較低,表現出低階免疫反應。從熱原產生機理角度看,注射時即使是微量的熱原同樣也會通過一類稱為Toll樣受體(TLR)的蛋白質,來觸發自然免疫系統,導致恒溫動物的體溫異常升高。
那么,熱原是如何通過免疫系統進行反應的呢?
Toll樣受體是跨膜蛋白,在所謂的前哨細胞(如巨噬細胞和樹突狀細胞)中占表達豐富,在先天免疫系統的激活中起著至關重要的作用。它們充當模式識別受體,由微生物或病原體相關分子識別觸發級聯反應。
迄今為止,已發現13種TLR家族蛋白,每種受體都充當一種或幾種特定配體的受體,作為對潛在有害微生物或其他外源劑的第一反應的基礎。例如,當細胞外TLR4識別大腸桿菌LPS的脂質A組分,并與其他反應協作,導致免疫細胞釋放熱原性細胞因子。其中兩種熱原細胞因子,即IL-1和IL-6,會刺激下丘腦,導致前列腺素E2的分泌,引起腦膜炎。其他LPS和NEPs也會與不同類TLR結合,觸發免疫系統級聯反應,產生發熱反應。這種反應是身體抵抗有害病原體能力的方式,然而,內毒素導致的發熱卻可能致命。熱原在體外對巨噬細胞以外的多種細胞也有直接作用。這些影響可能包括有絲分裂、抑制有絲分裂、誘導形態學改變和細胞毒性。
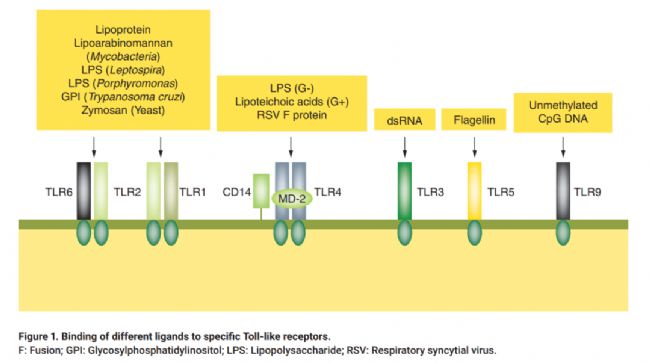 不同的熱原因子與TLR特異性結合方式
不同的熱原因子與TLR特異性結合方式




