剪切和動態壓縮在體外調節人單核細胞的炎癥表型
單核細胞和單核細胞衍生的巨噬細胞是關鍵的免疫效應細胞,在宿主防御中起著至關重要的作用,并有助于組織重塑和修復。巨噬細胞具有高度的可塑性,具有響應環境線索改變表型的潛力,并且可以根據促炎(M1)或抗炎(M2)亞群進行分類。浸潤的單核細胞和巨噬細胞可能會影響肌肉骨骼組織修復過程的成功。
單核細胞和巨噬細胞存在于重塑組織的部位,這些組織受到機械力的影響,并且與修復反應有關。隨著骨免疫學領域越來越重要,需要更詳細地研究機械刺激對免疫細胞表型的影響。然而,巨噬細胞和單核細胞(它們的譜系前體)對骨骼組織固有的機械力的反應以及這種機械刺激對巨噬細胞表型的影響需要進一步闡明。
因此,瑞士AO達沃斯研究所一項研究的目的是研究機械剪切和壓縮負荷對單核細胞活化和表型的影響。未刺激的、M1 或 M2 刺激的原代人單核細胞以及人單核細胞報告細胞系 THP1-Blue在體外暴露于剪切和壓縮負荷的組合中,在機械刺激 3 天后評估炎癥介質的基因表達水平和炎癥蛋白分泌。文章名為《Shear and Dynamic Compression Modulates the Inflammatory Phenotype of Human Monocytes in vitro》。
為了研究機械負荷對巨噬細胞表型的影響,在負載前72小時,用 10 ng/ml IFN-γ (干擾素-γ,人單核THP1細胞的重要激活因子)和 100 ng/ml LPS(脂多糖)刺激CD14+ 單核細胞,誘導其分化為促炎/M1 表型,10 ng/ml IL-4 誘導其分化為抗炎/M2 表型或未刺激。在加載前 24 小時制備含有 THP1-Blue 單核細胞的瓊脂糖凝膠。剪切(1 Hz,±25° ball rotation)和壓縮(10%,1 Hz 壓縮應變)每天1小時,連續3天。
多軸加載后差異激活的原代人單核細胞的促炎基因和蛋白質表達
與 IL-4 (白細胞介素-4)刺激的單核細胞相比,LPS和 IFN-γ 刺激的單核細胞在自由膨脹條件下具有顯著更高的促炎基因IL8和CCL2的基因表達水平(分別增加 10.3 倍和 28.3 倍),證實了其促炎癥表型(圖1 A)。此外,與 LPS 和 IFN-γ 刺激的單核細胞相比,IL-4 刺激的單核細胞與顯著更高的CCL18表達相關(增加 41.5 倍),證實了它們向 M2 樣表型的極化。
與在自由膨脹條件下培養的單核細胞相比,在機械負荷 3 天后,未受刺激的原代人單核細胞顯著上調促炎基因IL6(5.9 倍變化)和IL8(2.8 倍變化)的基因表達水平(圖1 B)。此外,與自由膨脹對照相比,所有四名供體的抗炎巨噬細胞標志物IL10的表達均降低,負載后供體 1 和 3 中檢測不到基因表達水平。炎癥介質CCL18、TNF和CCL2的表達水平無顯著差異。
雖然在機械負荷后觀察到 LPS 和 IFN-γ 激活的單核細胞對炎癥基因表達的相似趨勢,但在供體之間觀察到更大的變化,這些發現沒有統計學意義(圖1 C)。然而,CCL2的表達顯著降低(降低 1.9 倍)。此外,在負載后,來自供體 1 和 3 的 LPS 和 IFN-γ 刺激的單核細胞中也檢測不到 IL10的基因表達水平。與未刺激的單核細胞類似,IL-4 激活的細胞也顯著增加了IL6(8.9 倍變化)并降低了IL10(3.1 倍)的表達(圖1 D)。
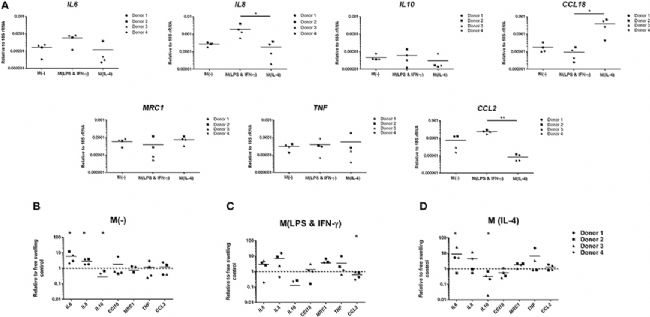
圖1 多軸加載后差異激活的原代人單核細胞的炎癥基因表達。
(A)由實時 PCR 測量的在自由膨脹條件下培養 6 天的原代單核細胞的基因表達。
(B)多軸負載 3 天后,未受刺激的原代人單核細胞或 LPS 和 IFN-γ(C)或 IL-4(D)刺激的單核細胞基因表達水平。
與自由膨脹對照相比,未受刺激的單核細胞的機械負荷顯著增加了促炎介質 TNF-α(17.1 ± 8.9 vs 8 ± 7.4 pg/ml)和 MIP-1α(636.8 ± 471.1 vs 124.1 ± 40.1 pg/ml)以及 IL-13(42.1 ± 19.8 vs 21.7 ± 13.6)的產生(圖2)。
由負載的未刺激單核細胞產生的 IL-10、CCL18、IP-10、MCP-1、MDC 和 IL-1β 的蛋白質水平與自由膨脹對照組沒有顯著差異。與基因表達水平相似,響應于未刺激的單核細胞的負載,IL-6 產生增加的趨勢。然而,觀察到較大的供體變異,這一發現在靜態上并不顯著。除了 TNF-α、MIP-1α 和 IL-13 之外,機械刺激顯著增加了LPS 和 IFN-γ 刺激的單核細胞的 MDC 水平(圖2)。與基因表達數據相似,IL-4 激活的單核細胞響應機械負荷 顯著增加促炎因子 IL-6、IL-8、TNF-α、MIP-1α、IP-10、IL-13、IL -1β 和 IL-10的表達,并降低 CCL18 和 MDC 的表達(圖2)。
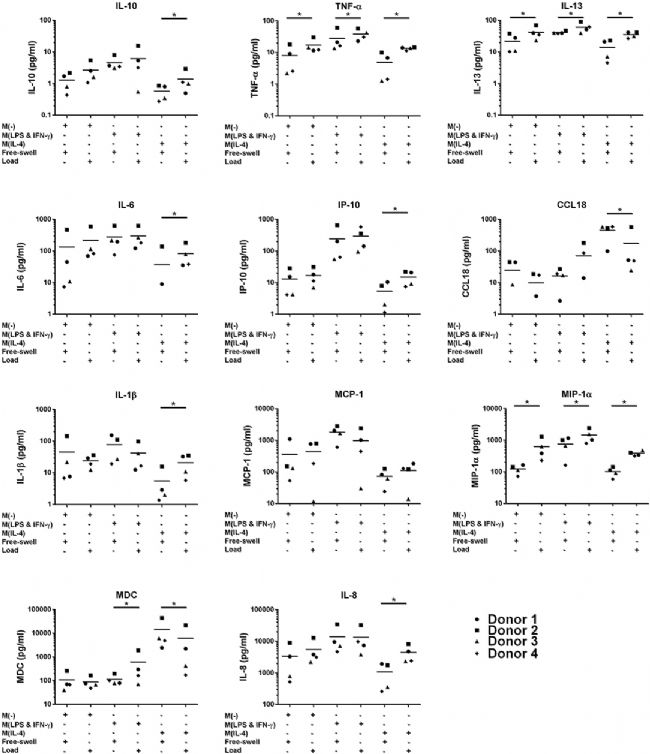
圖2 多軸加載后原代人單核細胞產生的炎癥介質,通過 ELISA 和多重測定進行量化。
IL-6:白細胞介素-6;IL-10:白細胞介素-10;CCL18:趨化因子(CC 基序)配體18;TNF-α:腫瘤壞死因子-α;MIP-1α:巨噬細胞炎癥蛋白-1α;IP-10:CXC 基序趨化因子 10;MCP-1:單核細胞趨化蛋白-1;IL-13:白細胞介素-13;MDC:巨噬細胞衍生趨化因子;IL-1β:白細胞介素-1β;IL-8:白細胞介素-8。
THP1-Blue 單核細胞在機械剪切力或壓縮力后的炎癥基因和蛋白質表達
為了評估機械剪切力或壓縮力對人類單核細胞炎癥基因和蛋白質表達的差異調節的潛力,將未受刺激的 THP1-Blue 單核細胞置于多軸負載條件下,或單獨進行機械剪切或壓縮。
THP1-Blue 單核細胞在機械負載 3 天后,與壓縮和剪切的組合以及的單獨剪切相比,單獨壓縮條件顯著上調促炎標志物NOS2和IL12B的基因表達水平(圖3)。IL6、IL-8、TNF- α、PTGS2、IL-10、CCL2和CCL18的基因表達水平在加載條件之間或與自由膨脹對照組相比沒有顯著差異。
然而,與對照相比,在從經受壓縮和剪切組合以及單獨壓縮和剪切3 天的凝膠中收獲的細胞培養基中檢測到顯著增加的 TNF-α、IL-10、IL-8、IL-13 和 MDC 水平(圖4 A)。此外,與所有其他培養條件相比,單獨施加壓縮載荷顯著上調了單核細胞產生的 IL-1β,而單獨施加剪切增加了 MCP-1 的釋放。
與自由膨脹培養物相比,IL-6 和 IP-10 的水平在響應任何加載條件時沒有顯著差異。除了調節炎性細胞因子的產生外,應用壓縮和剪切或單獨剪切可誘導 THP1-Blue 單核細胞釋放分泌的堿性磷酸酶,這表明 NF-κB 和 AP-1 轉錄因子被激活(圖4 B)。
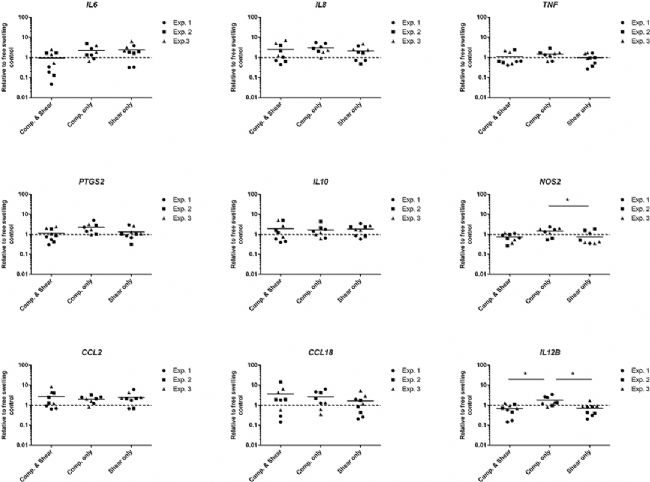
圖3 THP1-Blue 單核細胞在單獨響應多軸載荷、剪切或壓縮時表達的炎癥基因水平。通過實時 PCR 測量,THP1-Blue 單核細胞在單獨多軸加載、剪切或壓縮 3 天后的基因表達。
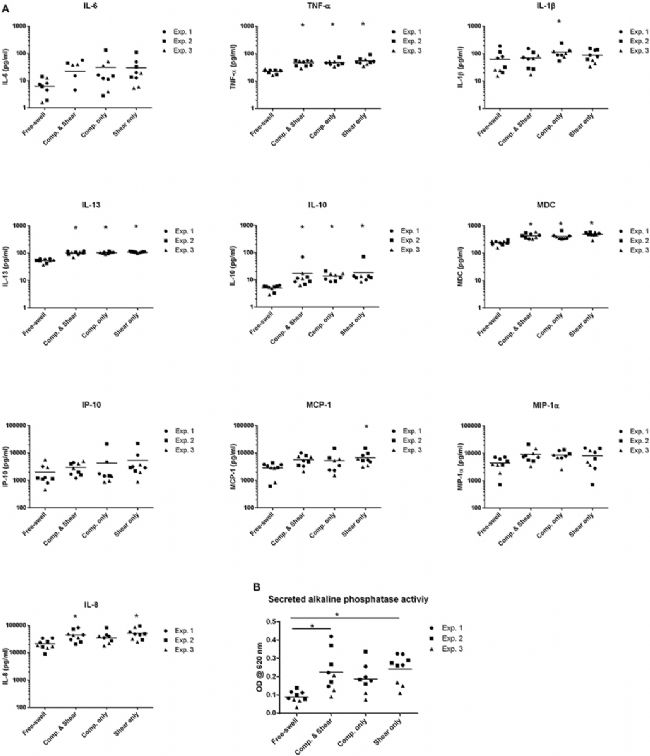
圖4 剪切和壓縮差異調節 THP1-Blue 單核細胞的炎癥介質表達。
(A)通過 ELISA 和多重測定法測量的多軸加載、剪切或壓縮 3 天后 THP1-Blue 單核細胞產生的炎癥介質水平。
(B)通過分光光度法測量,在加載 3 天后在細胞培養上清液中檢測到 SEAP 水平。
總之,該研究的結果表明,人類單核細胞對機械刺激有反應,并觀察到剪切力和壓縮負荷對促炎介質產生的調節作用。深入了解骨骼組織相關機械負荷對單核細胞行為的影響及其對局部細胞反應和組織修復過程的后續影響,可能會發現新的策略,以最大化炎癥介導的修復機制。此外,研究結果可能為開發新的康復醫學策略以改善骨骼組織修復的治療結果提供見解。
參考文獻:Fahy N, Menzel U, Alini M, Stoddart MJ. Shear and Dynamic Compression Modulates the Inflammatory Phenotype of Human Monocytes in vitro. Front Immunol. 2019 Mar 5;10:383. doi: 10.3389/fimmu.2019.00383. PMID: 30891042; PMCID: PMC6411641.
圖片均來源于參考文獻
文章來源:http://www.naturethink.com/?news/238.html
小編旨在分享、學習、交流生物科學等領域的研究進展。如有侵權或引文不當請聯系小編修正。微信搜索公眾號“Naturethink”,學習更多與流體應力刺激細胞培養相關知識吧!





