細胞基及其衍生物水凝膠應用于炎癥類疾病治療近期研究進展
原創 EFL EngineeringForLife
細胞基及其衍生物水凝膠相比傳統水凝膠,具有更高的生物安全性、多樣的生物學功能,涉及到細胞、蛋白、核酸等多個層次,被廣泛應用于診斷、治療、人造皮膚和組織工程等方面,取得不錯的治療效果。隨著水凝膠體系的深入功能化研究,更多細胞基及其衍生物水凝膠體系被設計開發出來,在體內發揮不同的生物學功能。例如,具有多功能性的細胞裂解液制備成的水凝膠可以有效地實現體內部分免疫細胞功能的調控;蛋白/核酸等水凝膠體系可以針對性提高某些疾病的體內蛋白藥物含量,相關的實驗結果均顯示在動物體內呈現出良好的疾病治療效果。這種生物多功能的水凝膠體系可用于加速臨床中生物醫用水凝膠治療體系的開發,提高腫瘤、自身性免疫類等相關疾病的治療效果。對于細胞基及其衍生物水凝膠的生物學效應及毒性的研究將作為生物醫藥研究中的重大創新,極大拓展了生物醫用類水凝膠在臨床疾病治療中的應用前景。近年圍繞細胞基及其衍生物水凝膠治療體系的相關研究呈井噴式的發展,至今有關論文發表數量已經累計上萬篇。在此,我們挑選了最新發表的數篇論文進行詳細介紹,方便大家進行相關內容的學習以及了解該領域的發展近況。
1. Advanced Healthcare Materials:富血小板裂解液血漿大孔水凝膠支架長期招募內源性M2巨噬細胞修復關節軟骨缺損
簡介:軟骨損傷后,大量單核/巨噬細胞浸潤臨近滑膜,滯留在滑膜組織中的巨噬細胞轉化為活化巨噬細胞(M1),分泌促炎細胞因子誘導持續炎癥反應和軟骨細胞凋亡。然而,目前臨床軟骨修復治療很少能達到長期的抗炎調節和滿意的結果。為了應對這些挑戰,中國科學院大學溫州研究院Junjie Deng教授開發了一種富含血小板溶解物的血漿大孔水凝膠(PLPMH)支架,可持續招募和極化內源性抗炎巨噬細胞(M2),以改善軟骨缺損修復。PLPMH支架可通過逐步降解穩定釋放鞘氨醇1-磷酸和蛋白,從而誘導M2巨噬細胞遷移或M0巨噬細胞遷移并極化至M2表型,提高抗炎細胞因子的分泌。此外,PLPMH支架在體內的炎癥反應可以忽略不計,可以促進內源性M2巨噬細胞大量長時間浸潤,提供局部抗炎微環境,甚至可以持續42天。在兔軟骨缺損模型中,PLPMH支架可以增加M2巨噬細胞比例,促進軟骨組織再生。這些研究支持PLPMH支架通過提供抗炎和促進再生的微環境,在關節軟骨組織工程中可能具有很大的潛力。相關工作“Long-Term Recruitment of Endogenous M2 Macrophages by Platelet Lysate-Rich Plasma Macroporous Hydrogel Scaffold for Articular Cartilage Defect Repair”于2022年1月7日發表在Advanced Healthcare Materials雜志上。
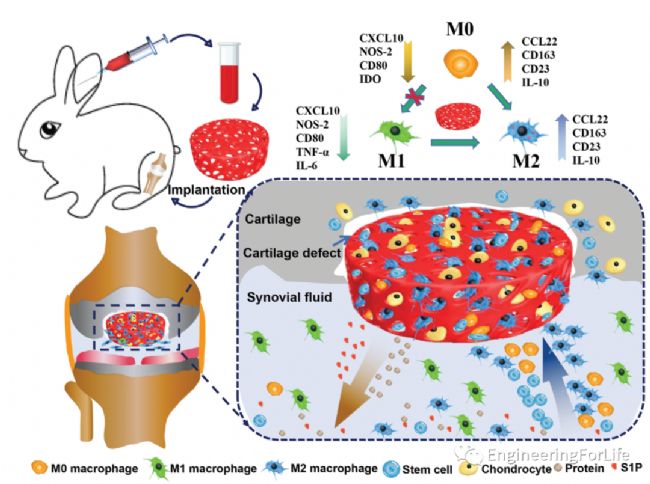 圖1 PLPMH支架制備及募集內源性M2巨噬細胞促進軟骨缺損修復示意圖
圖1 PLPMH支架制備及募集內源性M2巨噬細胞促進軟骨缺損修復示意圖
原文鏈接:
https://doi.org/10.1002/adhm.202101661
2. International Journal of Ophthalmology:人血小板裂解液/纖維蛋白水凝膠處理后的人角膜內皮細胞與Y-27632 ROCK抑制劑的比較培養:體外和體外研究
簡介:組織工程和細胞治療研究的進展為角膜內皮疾病患者提供了創新的治療方案。伊朗醫學科學沙希德·貝赫什提大學Mozhgan Rezaei Kanavi教授比較使用人血小板溶解物(HPL)/纖維蛋白水凝膠和使用Y-27632 ROCK抑制劑在體外和離體條件下培養人角膜內皮細胞(HCECs)的潛在影響。制備了人角膜內皮功能障礙的體外模型,結果相比之下,HPL/Fibrin水凝膠處理的細胞存活率與Y-27632 ROCK抑制劑處理的細胞存活率相似,但兩種處理的細胞存活率均高于對照組(FBS)。HPL/纖維蛋白水凝膠與Y-27632 ROCK抑制劑對HCECs的生長和粘附具有相似的誘導作用,但是用HPL/纖維蛋白水凝膠處理細胞的一個明顯優勢是,它是一種無異種和生物相容性的材料,在未來的臨床應用中可以有自體應用。相關工作“Comparative culture of human corneal endothelial cells following treatment with human platelet lysate/fibrin hydrogel versus Y-27632 ROCK inhibitor: in vitro and ex vivo study” 于2022年1月13日發表在International Journal of Ophthalmology雜志上。 圖2 圖示為HPL/纖維蛋白水凝膠制備和HCEC包封
圖2 圖示為HPL/纖維蛋白水凝膠制備和HCEC包封
原文鏈接:
https://doi.org/10.1007/s10792-021-02136-x
3. Biomaterials Science:通過外科手術腫瘤來源的個性化水凝膠疫苗抑制腫瘤復發和轉移
簡介:腫瘤復發和轉移已成為臨床腫瘤治療中的棘手問題。疫苗介導的抗腫瘤免疫反應已成為一種顯著的術后抑制腫瘤復發和轉移。然而,有限的腫瘤抗原并不利于觸發完全抗原特異性T細胞介導的免疫反應。中國科學院大學溫州研究院Junjie Deng教授開發了一種基于手術切除腫瘤細胞裂解液的含有粒細胞-巨噬細胞集落刺激因子(GM-CSF)的水凝膠疫苗系統。該水凝膠是由腫瘤細胞裂解液在低溫下交聯形成的。從水凝膠中釋放GM-CSF以招募樹突狀細胞,這提供了一個完全個性化的腫瘤抗原池。它們被結合在一起以促進強大的抗原特異性T細胞的產生。將個性化的水凝膠植入手術部位,刺激抗腫瘤免疫反應,抑制殘留的腫瘤細胞。令人高興的是,這種個性化的水凝膠結合程序化死亡配體1抗體(αPD-L1),在術后小鼠腫瘤模型中很好地抑制了腫瘤的復發和轉移。結果表明,個性化水凝膠的開發和αPD-L1的結合為預防腫瘤復發和轉移提供了一種新的策略。相關工作“Inhibition of tumor recurrence and metastasis via a surgical tumor-derived personalized hydrogel vaccine” 于2022年1月12日發表在Biomaterials Science雜志上。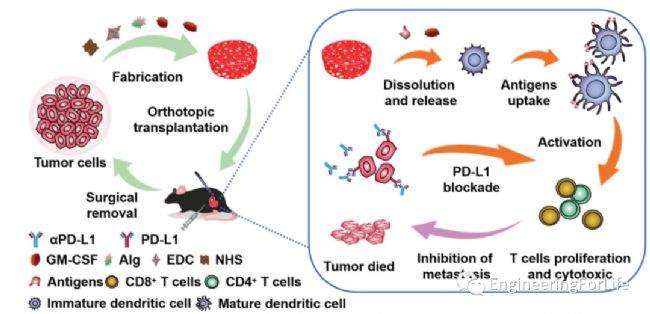 圖3 PTLDH制備及PTLDH介導的預防術后腫瘤復發轉移的腫瘤免疫治療示意圖
圖3 PTLDH制備及PTLDH介導的預防術后腫瘤復發轉移的腫瘤免疫治療示意圖
原文鏈接:
https://doi.org/10.1039/d1bm01596f
4. Advanced Materials:具有蛋白質編碼的獨立RNA水凝膠用于亞區域化翻譯
簡介:RNA可以自我折疊成復雜的結構,在蛋白質合成和催化中充當主要的生物調節因子。由于結構基元和功能多樣性的豐富,RNA已被用于設計自然定義的目標,盡管其固有的化學不穩定性和缺乏技術。成均館大學Soong Ho Um教授通過連接和滾動循環轉錄形成RNA G-四聯體開發了一種強大的、獨立的RNA水凝膠,能夠在亞區域的相分離翻譯環境中催化活性和增強幾種蛋白質的表達。這些觀察結果表明,這種水凝膠將擴大RNA研究,并影響實際的RNA原理和應用。相關工作“Protein-Encoding Free-Standing RNA Hydrogel for Sub-Compartmentalized Translation”于2022年4月4日發表在Advanced Materials雜志上。 圖4 自組裝的RCT產物形成具有固有功能的RNA G-四復合體(RG4)凝膠
圖4 自組裝的RCT產物形成具有固有功能的RNA G-四復合體(RG4)凝膠
原文鏈接:
https://doi.org/10.1002/adma.202110424
5. Scientific Reports:人胰腺ECM水凝膠優化了胰島微環境的三維建模
簡介:細胞外基質(ECM)扮演著多種角色,包括通過結構和生化相互作用支持細胞。為了更好地理解和支持胰島健康,并重現原生胰島環境,威斯康星大學麥迪遜分校醫學與公共衛生學院Jon S. Odorico教授希望有一個平臺可以讓胰島細胞與天然的ECM接觸培養,證明了從脫細胞的人類胰腺中衍生出一種實用且持久的水凝膠,支持人類胰島的生存和功能。與無胰腺基質培養的胰島相比,嵌在這種水凝膠中的胰島顯示葡萄糖和KCl增加了胰島素分泌,并改善了線粒體功能。在擴展培養中,與懸浮培養相比,水凝膠共培養顯著降低了細胞凋亡水平,并保存了受控的葡萄糖響應功能。與原位胰島相比,離體胰島的內分泌和非內分泌細胞排列發生改變;水凝膠保存了與原位觀察更相似的島狀結構。RNA測序證實,懸浮培養和水凝膠培養胰島的基因表達差異很大程度上屬于與細胞外信號傳導和粘附相關的基因本體論術語。天然胰腺ECM可改善離體胰島的生存和生理機能。相關工作“A human pancreatic ECM hydrogel optimized for 3‑D modeling of the islet microenvironment” 于2022年5月3日發表在Scientific Reports雜志上。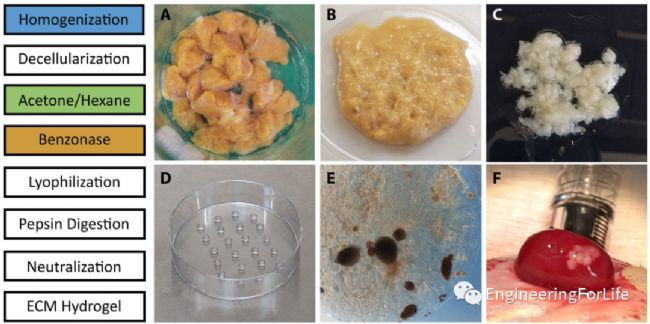 圖5 人胰腺ECM的脫細胞和凝膠化方案
圖5 人胰腺ECM的脫細胞和凝膠化方案
原文鏈接:
https://doi.org/10.1038/s41598-022-11085-z
6. ACS Applied Materials & Interfaces:動態生物反應性DNA水凝膠與端突來源的外泌體的雙功能干細胞結合促進糖尿病骨再生
簡介:高血糖和過表達的促炎細胞因子、蛋白酶(如基質金屬蛋白酶、MMPs)等顯著影響糖尿病(DM)患者骨缺損的再生。鑒于外泌體是一種很有前途的納米材料,重慶醫科大學Jinlin Song教授報道了來自根尖乳頭源性外泌體(SCAP-Exo)的干細胞在體外促進血管生成和成骨的優異能力,開發了一種生物反應性聚乙二醇(PEG)/DNA混合水凝膠,以支持SCAP-Exo的可控釋放,用于糖尿病骨缺損。該系統可能由病理線索(MMP-9)的升高觸發,以響應動態糖尿病微環境。進一步證實了可注射的scap -外源性PEG/DNA混合水凝膠對糖尿病大鼠下頜骨缺損具有促進血管蒂骨再生的作用。此外,miRNA測序提示SCAP-Exo的雙功能機制可能與miRNA-126-5p和miRNA-150-5p的高表達有關。為設計有前景的生物反應性外泌體遞送系統提供了有價值的見解,以改善糖尿病患者的骨再生。相關工作“Dynamically Bioresponsive DNA Hydrogel Incorporated with DualFunctional Stem Cells from Apical Papilla-Derived Exosomes Promotes Diabetic Bone Regeneration”于2022年3月28日發表在ACS Applied Materials & Interfaces雜志上。 圖6 SVAP-外源性PEG/DNA混合水凝膠促進糖尿病血管化骨再生的合成和治療原理
圖6 SVAP-外源性PEG/DNA混合水凝膠促進糖尿病血管化骨再生的合成和治療原理
原文鏈接:
https://doi.org/10.1021/acsami.2c02278
7. Biomaterials Advances:可溶解的微凝膠模板大孔水凝膠控制細胞組裝
簡介:間充質干細胞(MSCs)為基礎的治療已被廣泛用于促進組織再生和調節免疫/炎癥反應。間充質干細胞的治療潛力可以通過形成多細胞球形進一步提高。同時,具有大孔結構的水凝膠有利于提高細胞負載基質的傳質性能。印第安納大學-普渡大學Chien-Chi Lin教授報告了利用可快速溶解的球形細胞載微凝膠制備MSC載大孔水凝膠支架。采用串聯液滴微流控技術和巰基降冰片烯光聚合技術,制備了一種新型快速降解高分子聚乙二醇降冰片烯-多巴胺(PEGNB-Dopa)可溶微凝膠。載細胞的PEGNB-Dopa微凝膠隨后被包裹在另一個體積水凝膠基質中,其多孔結構是由PEGNB-Dopa微凝膠的快速降解有效地產生。這種原位成孔方法的細胞相容性已被證明與多種細胞類型。此外,調整塊體水凝膠的剛度和細胞粘附性,可以形成固體球或空心球。實心或空心MSC球體的組裝導致AKT通路的差異激活。最后,在大孔水凝膠中原位形成的MSCs固體球狀體顯示了HGF、VEGF-A、IL-6、IL-8和TIMP-2的強勁分泌。該平臺為形成細胞負載的大孔水凝膠提供了一種創新的方法,用于未來的各種生物醫學應用。相關工作“Dissolvable microgel-templated macroporous hydrogels for controlled cell assembly” 于2022年2月14日發表在Biomaterials Advances雜志上。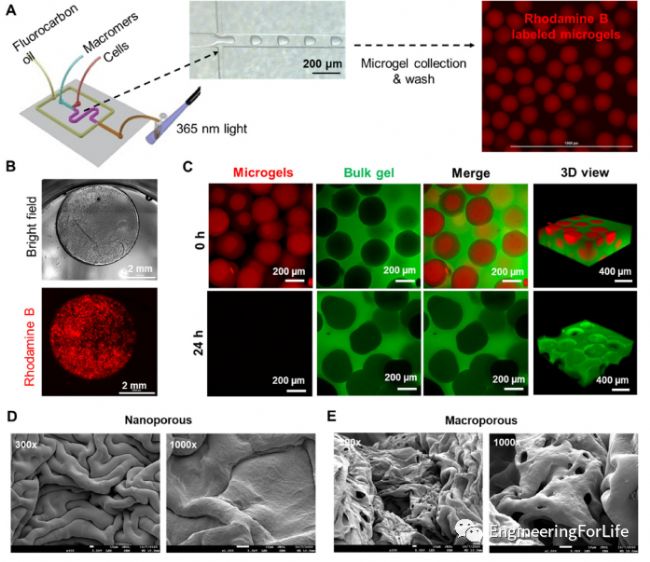 圖7 大孔水凝膠的制備與表征
圖7 大孔水凝膠的制備與表征
原文鏈接:
http://dx.doi.org/10.1016/j.msec.2022.112712
8. International Journal of Molecular Sciences:具有細胞外囊泡緩釋的重組人膠原蛋白水凝膠的制備及皮膚創面愈合
簡介:現有的治療方法難以有效促進皮膚創面愈合,這對臨床治療提出了嚴峻的挑戰。干細胞分泌的細胞外囊泡(EV)已被證明有助于傷口組織的再生和修復,但它們不能被靶向和持續,這嚴重限制了它們目前的治療潛力。重組人膠原蛋白III (rhCol III)具有水溶性好、無病毒隱患、排異率低、生產工藝穩定等優點。為了實現EV的位點特異性緩釋,南開大學Shufang Wang教授通過與鏈霉菌的谷氨酰胺轉胺酶交聯制備了rhCol III水凝膠,該凝膠具有孔徑均勻、生物相容性好等特點。rhCol III - EV水凝膠能有效促進巨噬細胞由M1型向M2型的轉變、L929細胞的遷移能力以及人臍靜脈內皮細胞(HUVECs)的血管生成。此外,在糖尿病大鼠皮膚損傷模型中,rhCol III - EV水凝膠被證明可以通過抑制炎癥反應和促進細胞增殖和血管生成來促進傷口愈合。結果表明,rhCol III -EV水凝膠可作為一種新型的EV傳遞生物材料,在皮膚創面愈合方面具有重要的應用價值。相關工作“Preparation of Recombinant Human Collagen III Protein Hydrogels with Sustained Release of Extracellular Vesicles for Skin Wound Healing” 于2022年6月3日發表在International Journal of Molecular Sciences雜志上。 圖8 rhCol III水凝膠的制備
圖8 rhCol III水凝膠的制備
原文鏈接:
https://doi.org/10.3390/ijms23116289
9. Carbohydrate Polymers:一種富含MnO2納米酶的透明質酸/血小板血漿水凝膠有效地緩解體內骨關節炎
簡介:由于其復雜的發病機制,骨關節炎(OA)的癥狀不能通過使用單一的功能成分完全治愈。浙江大學Changyou Gao教授通過將牛血清白蛋白(BSA)-MnO2 (BM)納米顆粒(NPs)分散到透明質酸(HA)/富血小板血漿(PRP)凝膠網絡中,通過席夫堿反應交聯,制備了MnO2納米酶包被水凝膠。由于希夫堿鍵的自愈性和pH響應特性,水凝膠不僅具有粘補功能,而且在PRP中表現出pH響應釋放BM NPs和生長因子。BM NPs可減輕嚴重氧化應激,PRP可促進軟骨細胞增殖。在大鼠OA模型中,HA/PRP/BM水凝膠顯著抑制軟骨基質降解。體外和體內研究表明,該新型水凝膠平臺可通過機械耗散的協同作用抑制骨關節炎的發展,抑制炎癥反應,促進軟骨修復,在骨性關節炎的治療中具有重要的應用前景。相關工作“A hyaluronic acid/platelet-rich plasma hydrogel containing MnO2 nanozymes efficiently alleviates osteoarthritis in vivo” 于2022年5月25日發表在Carbohydrate Polymers雜志上。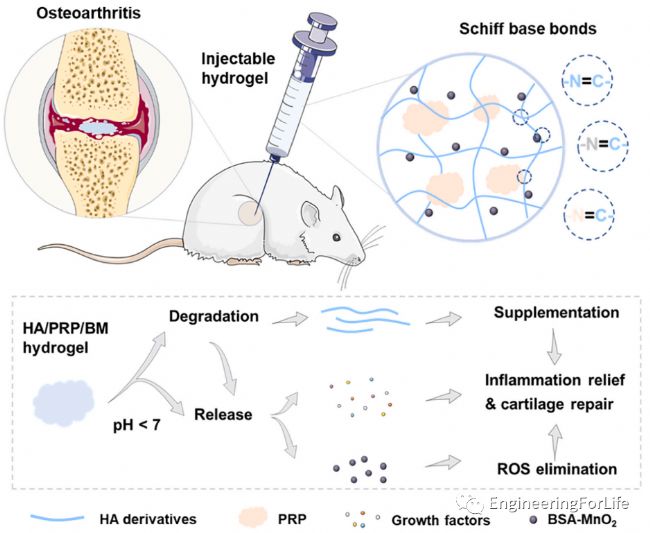 圖9 希夫堿反應制備的HA/PRP/BM可注射水凝膠示意圖,及其協同治療骨關節炎
圖9 希夫堿反應制備的HA/PRP/BM可注射水凝膠示意圖,及其協同治療骨關節炎
原文鏈接:
https://doi.org/10.1016/j.carbpol.2022.119667
10. ACS Applied Bio Materials:通過重組細菌膠原-透明質酸水凝膠構建可調控的腫瘤微環境
簡介:腫瘤微環境的模型需要控制機械和生化特性,以確保準確模擬患者的疾病。與純天然或合成材料相比,將重組蛋白片段與合成支架配對的雜交方法顯示出許多優勢。新南威爾士大學Kristopher A. Kilian教授展示了一種重組細菌膠原樣蛋白(CLP)的生產,用于巰基烯與降冰片烯功能化透明質酸(NorHA)的配對。合成的水凝膠材料顯示了可調節的模量,具有類似天然腫瘤基質的應變加強行為的證據。加入半胱氨酸末端肽結合基序來調整細胞粘附點。模塊化混合凝膠顯示了良好的生物相容性,并被證明可以控制MCF7和MD-MBA-231乳腺腺癌細胞的粘附、增殖和侵襲特性。多種結構和生物活性成分的容易集成為基礎研究和藥物開發提供了一個強大的框架來形成腫瘤微環境模型。相關工作“A Tunable Tumor Microenvironment through Recombinant Bacterial Collagen-Hyaluronic Acid Hydrogels”于2022年5月22日發表在ACS Applied Bio Materials雜志上。 圖10 重組雜化膠原樣蛋白(CLP)、去冰片烯功能化透明質酸水凝膠(NorHA)示意圖
圖10 重組雜化膠原樣蛋白(CLP)、去冰片烯功能化透明質酸水凝膠(NorHA)示意圖
原文鏈接:
https://doi.org/10.1021/acsabm.2c00186
細胞基及其衍生物水凝膠相比傳統水凝膠,具有更高的生物安全性、多樣的生物學功能,涉及到細胞、蛋白、核酸等多個層次,被廣泛應用于診斷、治療、人造皮膚和組織工程等方面,取得不錯的治療效果。隨著水凝膠體系的深入功能化研究,更多細胞基及其衍生物水凝膠體系被設計開發出來,在體內發揮不同的生物學功能。例如,具有多功能性的細胞裂解液制備成的水凝膠可以有效地實現體內部分免疫細胞功能的調控;蛋白/核酸等水凝膠體系可以針對性提高某些疾病的體內蛋白藥物含量,相關的實驗結果均顯示在動物體內呈現出良好的疾病治療效果。這種生物多功能的水凝膠體系可用于加速臨床中生物醫用水凝膠治療體系的開發,提高腫瘤、自身性免疫類等相關疾病的治療效果。對于細胞基及其衍生物水凝膠的生物學效應及毒性的研究將作為生物醫藥研究中的重大創新,極大拓展了生物醫用類水凝膠在臨床疾病治療中的應用前景。近年圍繞細胞基及其衍生物水凝膠治療體系的相關研究呈井噴式的發展,至今有關論文發表數量已經累計上萬篇。在此,我們挑選了最新發表的數篇論文進行詳細介紹,方便大家進行相關內容的學習以及了解該領域的發展近況。
1. Advanced Healthcare Materials:富血小板裂解液血漿大孔水凝膠支架長期招募內源性M2巨噬細胞修復關節軟骨缺損
簡介:軟骨損傷后,大量單核/巨噬細胞浸潤臨近滑膜,滯留在滑膜組織中的巨噬細胞轉化為活化巨噬細胞(M1),分泌促炎細胞因子誘導持續炎癥反應和軟骨細胞凋亡。然而,目前臨床軟骨修復治療很少能達到長期的抗炎調節和滿意的結果。為了應對這些挑戰,中國科學院大學溫州研究院Junjie Deng教授開發了一種富含血小板溶解物的血漿大孔水凝膠(PLPMH)支架,可持續招募和極化內源性抗炎巨噬細胞(M2),以改善軟骨缺損修復。PLPMH支架可通過逐步降解穩定釋放鞘氨醇1-磷酸和蛋白,從而誘導M2巨噬細胞遷移或M0巨噬細胞遷移并極化至M2表型,提高抗炎細胞因子的分泌。此外,PLPMH支架在體內的炎癥反應可以忽略不計,可以促進內源性M2巨噬細胞大量長時間浸潤,提供局部抗炎微環境,甚至可以持續42天。在兔軟骨缺損模型中,PLPMH支架可以增加M2巨噬細胞比例,促進軟骨組織再生。這些研究支持PLPMH支架通過提供抗炎和促進再生的微環境,在關節軟骨組織工程中可能具有很大的潛力。相關工作“Long-Term Recruitment of Endogenous M2 Macrophages by Platelet Lysate-Rich Plasma Macroporous Hydrogel Scaffold for Articular Cartilage Defect Repair”于2022年1月7日發表在Advanced Healthcare Materials雜志上。

原文鏈接:
https://doi.org/10.1002/adhm.202101661
2. International Journal of Ophthalmology:人血小板裂解液/纖維蛋白水凝膠處理后的人角膜內皮細胞與Y-27632 ROCK抑制劑的比較培養:體外和體外研究
簡介:組織工程和細胞治療研究的進展為角膜內皮疾病患者提供了創新的治療方案。伊朗醫學科學沙希德·貝赫什提大學Mozhgan Rezaei Kanavi教授比較使用人血小板溶解物(HPL)/纖維蛋白水凝膠和使用Y-27632 ROCK抑制劑在體外和離體條件下培養人角膜內皮細胞(HCECs)的潛在影響。制備了人角膜內皮功能障礙的體外模型,結果相比之下,HPL/Fibrin水凝膠處理的細胞存活率與Y-27632 ROCK抑制劑處理的細胞存活率相似,但兩種處理的細胞存活率均高于對照組(FBS)。HPL/纖維蛋白水凝膠與Y-27632 ROCK抑制劑對HCECs的生長和粘附具有相似的誘導作用,但是用HPL/纖維蛋白水凝膠處理細胞的一個明顯優勢是,它是一種無異種和生物相容性的材料,在未來的臨床應用中可以有自體應用。相關工作“Comparative culture of human corneal endothelial cells following treatment with human platelet lysate/fibrin hydrogel versus Y-27632 ROCK inhibitor: in vitro and ex vivo study” 于2022年1月13日發表在International Journal of Ophthalmology雜志上。

原文鏈接:
https://doi.org/10.1007/s10792-021-02136-x
3. Biomaterials Science:通過外科手術腫瘤來源的個性化水凝膠疫苗抑制腫瘤復發和轉移
簡介:腫瘤復發和轉移已成為臨床腫瘤治療中的棘手問題。疫苗介導的抗腫瘤免疫反應已成為一種顯著的術后抑制腫瘤復發和轉移。然而,有限的腫瘤抗原并不利于觸發完全抗原特異性T細胞介導的免疫反應。中國科學院大學溫州研究院Junjie Deng教授開發了一種基于手術切除腫瘤細胞裂解液的含有粒細胞-巨噬細胞集落刺激因子(GM-CSF)的水凝膠疫苗系統。該水凝膠是由腫瘤細胞裂解液在低溫下交聯形成的。從水凝膠中釋放GM-CSF以招募樹突狀細胞,這提供了一個完全個性化的腫瘤抗原池。它們被結合在一起以促進強大的抗原特異性T細胞的產生。將個性化的水凝膠植入手術部位,刺激抗腫瘤免疫反應,抑制殘留的腫瘤細胞。令人高興的是,這種個性化的水凝膠結合程序化死亡配體1抗體(αPD-L1),在術后小鼠腫瘤模型中很好地抑制了腫瘤的復發和轉移。結果表明,個性化水凝膠的開發和αPD-L1的結合為預防腫瘤復發和轉移提供了一種新的策略。相關工作“Inhibition of tumor recurrence and metastasis via a surgical tumor-derived personalized hydrogel vaccine” 于2022年1月12日發表在Biomaterials Science雜志上。

原文鏈接:
https://doi.org/10.1039/d1bm01596f
4. Advanced Materials:具有蛋白質編碼的獨立RNA水凝膠用于亞區域化翻譯
簡介:RNA可以自我折疊成復雜的結構,在蛋白質合成和催化中充當主要的生物調節因子。由于結構基元和功能多樣性的豐富,RNA已被用于設計自然定義的目標,盡管其固有的化學不穩定性和缺乏技術。成均館大學Soong Ho Um教授通過連接和滾動循環轉錄形成RNA G-四聯體開發了一種強大的、獨立的RNA水凝膠,能夠在亞區域的相分離翻譯環境中催化活性和增強幾種蛋白質的表達。這些觀察結果表明,這種水凝膠將擴大RNA研究,并影響實際的RNA原理和應用。相關工作“Protein-Encoding Free-Standing RNA Hydrogel for Sub-Compartmentalized Translation”于2022年4月4日發表在Advanced Materials雜志上。

原文鏈接:
https://doi.org/10.1002/adma.202110424
5. Scientific Reports:人胰腺ECM水凝膠優化了胰島微環境的三維建模
簡介:細胞外基質(ECM)扮演著多種角色,包括通過結構和生化相互作用支持細胞。為了更好地理解和支持胰島健康,并重現原生胰島環境,威斯康星大學麥迪遜分校醫學與公共衛生學院Jon S. Odorico教授希望有一個平臺可以讓胰島細胞與天然的ECM接觸培養,證明了從脫細胞的人類胰腺中衍生出一種實用且持久的水凝膠,支持人類胰島的生存和功能。與無胰腺基質培養的胰島相比,嵌在這種水凝膠中的胰島顯示葡萄糖和KCl增加了胰島素分泌,并改善了線粒體功能。在擴展培養中,與懸浮培養相比,水凝膠共培養顯著降低了細胞凋亡水平,并保存了受控的葡萄糖響應功能。與原位胰島相比,離體胰島的內分泌和非內分泌細胞排列發生改變;水凝膠保存了與原位觀察更相似的島狀結構。RNA測序證實,懸浮培養和水凝膠培養胰島的基因表達差異很大程度上屬于與細胞外信號傳導和粘附相關的基因本體論術語。天然胰腺ECM可改善離體胰島的生存和生理機能。相關工作“A human pancreatic ECM hydrogel optimized for 3‑D modeling of the islet microenvironment” 于2022年5月3日發表在Scientific Reports雜志上。

原文鏈接:
https://doi.org/10.1038/s41598-022-11085-z
6. ACS Applied Materials & Interfaces:動態生物反應性DNA水凝膠與端突來源的外泌體的雙功能干細胞結合促進糖尿病骨再生
簡介:高血糖和過表達的促炎細胞因子、蛋白酶(如基質金屬蛋白酶、MMPs)等顯著影響糖尿病(DM)患者骨缺損的再生。鑒于外泌體是一種很有前途的納米材料,重慶醫科大學Jinlin Song教授報道了來自根尖乳頭源性外泌體(SCAP-Exo)的干細胞在體外促進血管生成和成骨的優異能力,開發了一種生物反應性聚乙二醇(PEG)/DNA混合水凝膠,以支持SCAP-Exo的可控釋放,用于糖尿病骨缺損。該系統可能由病理線索(MMP-9)的升高觸發,以響應動態糖尿病微環境。進一步證實了可注射的scap -外源性PEG/DNA混合水凝膠對糖尿病大鼠下頜骨缺損具有促進血管蒂骨再生的作用。此外,miRNA測序提示SCAP-Exo的雙功能機制可能與miRNA-126-5p和miRNA-150-5p的高表達有關。為設計有前景的生物反應性外泌體遞送系統提供了有價值的見解,以改善糖尿病患者的骨再生。相關工作“Dynamically Bioresponsive DNA Hydrogel Incorporated with DualFunctional Stem Cells from Apical Papilla-Derived Exosomes Promotes Diabetic Bone Regeneration”于2022年3月28日發表在ACS Applied Materials & Interfaces雜志上。

原文鏈接:
https://doi.org/10.1021/acsami.2c02278
7. Biomaterials Advances:可溶解的微凝膠模板大孔水凝膠控制細胞組裝
簡介:間充質干細胞(MSCs)為基礎的治療已被廣泛用于促進組織再生和調節免疫/炎癥反應。間充質干細胞的治療潛力可以通過形成多細胞球形進一步提高。同時,具有大孔結構的水凝膠有利于提高細胞負載基質的傳質性能。印第安納大學-普渡大學Chien-Chi Lin教授報告了利用可快速溶解的球形細胞載微凝膠制備MSC載大孔水凝膠支架。采用串聯液滴微流控技術和巰基降冰片烯光聚合技術,制備了一種新型快速降解高分子聚乙二醇降冰片烯-多巴胺(PEGNB-Dopa)可溶微凝膠。載細胞的PEGNB-Dopa微凝膠隨后被包裹在另一個體積水凝膠基質中,其多孔結構是由PEGNB-Dopa微凝膠的快速降解有效地產生。這種原位成孔方法的細胞相容性已被證明與多種細胞類型。此外,調整塊體水凝膠的剛度和細胞粘附性,可以形成固體球或空心球。實心或空心MSC球體的組裝導致AKT通路的差異激活。最后,在大孔水凝膠中原位形成的MSCs固體球狀體顯示了HGF、VEGF-A、IL-6、IL-8和TIMP-2的強勁分泌。該平臺為形成細胞負載的大孔水凝膠提供了一種創新的方法,用于未來的各種生物醫學應用。相關工作“Dissolvable microgel-templated macroporous hydrogels for controlled cell assembly” 于2022年2月14日發表在Biomaterials Advances雜志上。

原文鏈接:
http://dx.doi.org/10.1016/j.msec.2022.112712
8. International Journal of Molecular Sciences:具有細胞外囊泡緩釋的重組人膠原蛋白水凝膠的制備及皮膚創面愈合
簡介:現有的治療方法難以有效促進皮膚創面愈合,這對臨床治療提出了嚴峻的挑戰。干細胞分泌的細胞外囊泡(EV)已被證明有助于傷口組織的再生和修復,但它們不能被靶向和持續,這嚴重限制了它們目前的治療潛力。重組人膠原蛋白III (rhCol III)具有水溶性好、無病毒隱患、排異率低、生產工藝穩定等優點。為了實現EV的位點特異性緩釋,南開大學Shufang Wang教授通過與鏈霉菌的谷氨酰胺轉胺酶交聯制備了rhCol III水凝膠,該凝膠具有孔徑均勻、生物相容性好等特點。rhCol III - EV水凝膠能有效促進巨噬細胞由M1型向M2型的轉變、L929細胞的遷移能力以及人臍靜脈內皮細胞(HUVECs)的血管生成。此外,在糖尿病大鼠皮膚損傷模型中,rhCol III - EV水凝膠被證明可以通過抑制炎癥反應和促進細胞增殖和血管生成來促進傷口愈合。結果表明,rhCol III -EV水凝膠可作為一種新型的EV傳遞生物材料,在皮膚創面愈合方面具有重要的應用價值。相關工作“Preparation of Recombinant Human Collagen III Protein Hydrogels with Sustained Release of Extracellular Vesicles for Skin Wound Healing” 于2022年6月3日發表在International Journal of Molecular Sciences雜志上。

原文鏈接:
https://doi.org/10.3390/ijms23116289
9. Carbohydrate Polymers:一種富含MnO2納米酶的透明質酸/血小板血漿水凝膠有效地緩解體內骨關節炎
簡介:由于其復雜的發病機制,骨關節炎(OA)的癥狀不能通過使用單一的功能成分完全治愈。浙江大學Changyou Gao教授通過將牛血清白蛋白(BSA)-MnO2 (BM)納米顆粒(NPs)分散到透明質酸(HA)/富血小板血漿(PRP)凝膠網絡中,通過席夫堿反應交聯,制備了MnO2納米酶包被水凝膠。由于希夫堿鍵的自愈性和pH響應特性,水凝膠不僅具有粘補功能,而且在PRP中表現出pH響應釋放BM NPs和生長因子。BM NPs可減輕嚴重氧化應激,PRP可促進軟骨細胞增殖。在大鼠OA模型中,HA/PRP/BM水凝膠顯著抑制軟骨基質降解。體外和體內研究表明,該新型水凝膠平臺可通過機械耗散的協同作用抑制骨關節炎的發展,抑制炎癥反應,促進軟骨修復,在骨性關節炎的治療中具有重要的應用前景。相關工作“A hyaluronic acid/platelet-rich plasma hydrogel containing MnO2 nanozymes efficiently alleviates osteoarthritis in vivo” 于2022年5月25日發表在Carbohydrate Polymers雜志上。

原文鏈接:
https://doi.org/10.1016/j.carbpol.2022.119667
10. ACS Applied Bio Materials:通過重組細菌膠原-透明質酸水凝膠構建可調控的腫瘤微環境
簡介:腫瘤微環境的模型需要控制機械和生化特性,以確保準確模擬患者的疾病。與純天然或合成材料相比,將重組蛋白片段與合成支架配對的雜交方法顯示出許多優勢。新南威爾士大學Kristopher A. Kilian教授展示了一種重組細菌膠原樣蛋白(CLP)的生產,用于巰基烯與降冰片烯功能化透明質酸(NorHA)的配對。合成的水凝膠材料顯示了可調節的模量,具有類似天然腫瘤基質的應變加強行為的證據。加入半胱氨酸末端肽結合基序來調整細胞粘附點。模塊化混合凝膠顯示了良好的生物相容性,并被證明可以控制MCF7和MD-MBA-231乳腺腺癌細胞的粘附、增殖和侵襲特性。多種結構和生物活性成分的容易集成為基礎研究和藥物開發提供了一個強大的框架來形成腫瘤微環境模型。相關工作“A Tunable Tumor Microenvironment through Recombinant Bacterial Collagen-Hyaluronic Acid Hydrogels”于2022年5月22日發表在ACS Applied Bio Materials雜志上。

原文鏈接:
https://doi.org/10.1021/acsabm.2c00186
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





