BEX電轉化儀CUY21 EDIT II 在外泌體載藥的應用
外泌體,活細胞釋放到細胞外微環境的磷脂雙分子囊泡,其直徑大小約為30~150nm。因天然外泌體內部富含脂質、蛋白質和核酸等物質的特性,近年來外泌體作為藥物遞送載體受到了越來越多研究者們的關注。研究表明外泌體可以作為載體,裝載化合物、蛋白及核酸并遞送至目標細胞。
與傳統的基因載體相比,外泌體載體優勢在于以下幾個方面:
(1)外泌體作為內源性囊泡其免疫原性低;
(2)生物相容性結構使外泌體易于進入細胞提高藥物遞送效率;
(3)外泌體膜可保護治療性核酸免受降解;
(4)外泌體可以避免吞噬作用和在體液中具有良好的耐受性;
(5)外泌體膜便于設計用于靶向遞送。
外泌體作為天然載體的重要意義日益凸顯,但是要實現高效、質量可控的載藥外泌體的規模化生產,外泌體的包裝技術是非常重要的一步。在包裝的過程中需要在避免對外泌體的過度損傷的基礎上盡可能提高封裝效率。
CUY21EDITII電轉儀通過對外泌體囊泡施加適當的電流擊穿形成囊泡微孔, 藥物通過形成微孔加載到外泌體中,外泌體膜隨后會很快恢復完成封裝。CUY21EDITII獨特的動態衰減脈沖技術及恒流電阻測定技術使轉染過程中電流輸出更穩定,從而高效封裝藥物載入外泌體中。
下面我們來分享兩篇2022年的文獻,來解釋CUY21EDITII的工作模式。
01Milk exosomes-mediated miR-31-5p delivery accelerates diabetic wound healing through promoting angiogenesis

摘要:MicroRNA(miRNA)為關鍵生物過程中基因表達的重要調節劑,是糖尿病傷口治療領域的一種有前途的核酸藥物,但是因為缺乏有效的遞送系統導致其miRNA療法受到限制。實驗中我們發現糖尿病小鼠傷口中miR-31-5p表達顯著降低,同時相關研究表明miR-31-5p也具有促進內皮細胞的增殖,遷移和血管生成的作用,因此我們嘗試使用牛奶來源的外泌體作為miR-31-5p遞送系統對糖尿病傷口進行治療。本研究通過電穿孔成功地將miR-31-5p模擬物封裝到牛奶外泌體中,結果顯示,負載在外泌體中的miR-31-5p實現了更高的細胞攝取并且能夠抵抗降解。此外miRNA-外泌體制劑在體外顯示出內皮細胞功能的顯著改善可以促進血管生成和增強體內糖尿病傷口愈合。綜合研究結果,牛奶外泌體作為可擴展生物相容性和具有成本效益的遞送系統的可行性,可提高miRNA的生物利用度和功效。
方法:使用CUY21EDITII來進行miR-31-5p外泌體封裝

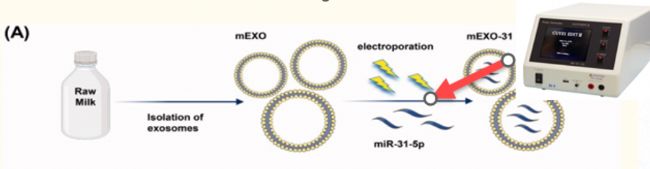
圖1:分離乳源性外泌體(mEXO)和制備miR-31-5p負載外泌體(mEXO-31)

圖2:共聚焦圖像顯示miR-31-5p成功加載到mEXO中。紅色和綠色熒光分別代表mEXO和FAM標記miR-31-5p模擬物
02
Optimization of siRNA loading into exosomes by electroporation

摘要:外泌體作為天然載體,作為一種副作用較少的藥物遞送工具受到關注。在這項研究中使用電穿孔將siRNA引入外泌體并優化轉導的條件。我們使用 CUY21EDITII進行電穿孔,儀器可以輸出高壓瞬時擊穿和低壓驅動的組合,將siRNA螢光素酶引入A375細胞衍生的外泌體中,隨后將外泌體添加到表達螢光素酶基因的細胞中,通過沉默細胞熒光素酶表達來確定外泌體包裝情況。研究結果表明CUY21EDITII成功將siRNA引入外泌體,并可以引起相比對照組約50%的發光強度降低。
方法:使用CUY21EDITII 將siRNA電穿孔到從A375-luc2 細胞系中提取外泌體中。通過改變轉染條件進行優化。
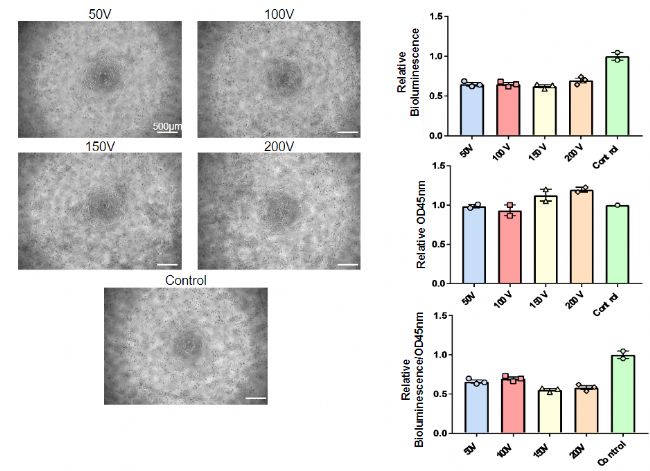
圖3:使用CUY21EDIT II確定 siRNA 轉染效率的最佳電壓為150v
BEX電轉化儀
CUY21EDITⅡ多模式高效基因電轉化儀,可將外源基因高效導入到原代細胞等難轉染細胞、細胞系、外泌體、受精卵、動物組織或器官中,不依賴于特殊的轉染試劑即可實現高效轉染,是一款真正的多模式,全功能基因電轉化儀。

參考文獻
[1].Yan C, Chen J, Wang C, et al. Milk exosomes-mediated miR-31-5p delivery accelerates diabetic wound healing through promoting angiogenesis. Drug Deliv. 2022 Dec;29(1):214-228. doi: 10.1080/10717544.2021.2023699. PMID: 34985397; PMCID: PMC874124.
[2]BEX日本分子生物學年會展
· 篇幅有限,詳情請咨詢我司獲悉,歡迎預約試用樣機!