Cytena單細胞打印機助力新冠病毒棘突蛋白的開發
因此,認識和理解COVID-19感染途徑和發病機制對其防控和治療具有重要意義。作為新平臺,單細胞技術的成熟在整個生命科學領域的廣泛應用催生了許多重要的生物學發現,也意味著在臨床研究上會有一批新的突破,所以單細胞分離篩選在SARS-CoV-2研究中起到尤為重要的作用。
新冠病毒的起源發展
自20世紀30年代末以來,人們就知道了動物冠狀病毒,最近的研究將Human coronaviruses (HCoVs)的進化與加速的城市化和家禽養殖聯系起來;這些做法允許頻繁的物種交換和簡化物種屏障的跨越,研究人員通過研究SARS-CoV-2和相關sarbecovirus (SARS-CoV-2屬于蝙蝠和穿山甲病毒的病毒群)的突變過程發現了相當顯著的變化,早在1983年,有證據強烈表明單峰駱駝是MERS CoV的重要宿主;據預測,這種祖傳病毒會從蝙蝠身上跨越物種屏障,進入單峰駱駝體內。后來,穿山甲被認為是SARS-CoV-2的潛在中間宿主,因為它與穿山甲中的CoV具有99%的遺傳同源性;但它們都是在SARS-CoV-2出現在人類之前。這也說明,許多冠狀病毒具有“通才”的特性且在宿主之間跳躍能力明顯,而這一特性使得冠狀病毒可能在傳染給人類之前就已經在蝙蝠中得到進化了[1]。

圖1. 冠狀病毒的起源和向人類的傳播途徑
大流行的人類冠狀病毒的棘突蛋白對于其進入人體細胞至關重要。事實上,大多數針對嚴重急性呼吸系統綜合冠狀病毒 2 (SARS-CoV-2) 的中和抗體是針對病毒表面暴露的棘突蛋白,使其成為疫苗和診斷測試的首選抗原。在當前大流行的背景下,全球對棘突蛋白的需求迅速增加,每年可能超過數百克至公斤。冠狀病毒棘突是高度糖基化的同源三聚體復合物,具有固有的結構靈活性和不穩定性。可制造性差現威脅到這些蛋白質用于疫苗和診斷測試的可用性。所以尋求一種能夠穩定生產三聚體棘突蛋白(Trimeric spike protein,S蛋白)的工藝尤為重要。
SARS-CoV-2 S蛋白的設計
SARS-CoV-2 S蛋白的編碼DNA的密碼子經過優化,一共設計了11個DNA結構體(圖2),并由ATUM公司合成。添加了一個功能性IgG先導序列來介導有效的信號肽切割。添加編碼組氨酸(8-聚體)的DNA用于羧基末端表達。如前所述,furin裂解位點RRAR突變為非功能性。在三聚體設計中,將跨膜區和C端細胞內的尾端去除,用一個T4折疊子序列取代。對于RBD片段(aa319-541),添加了IgG leader和His標簽序列。由于攜帶D614G氨基酸變化的SARS-CoV-2變異體的廣泛出現,本研究中也包括了這種棘突蛋白變異 。
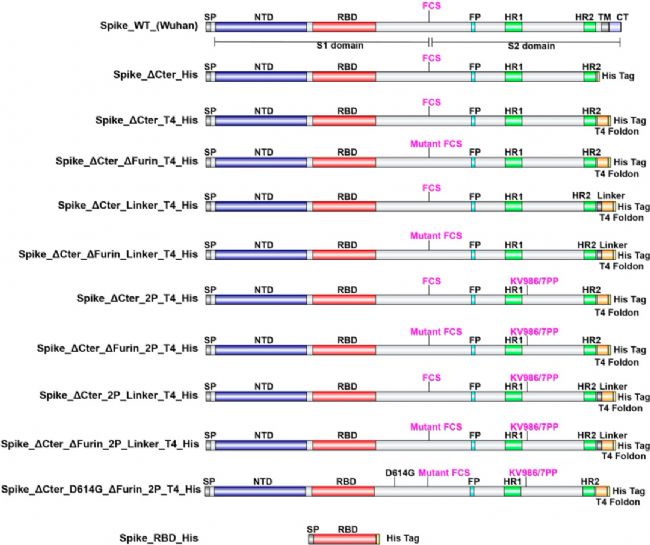
圖 2. Schematic representation of SARS-CoV-2 spike protein designs.
單克隆細胞株的篩選和三聚體棘突蛋白表達
采用CHO4Tx的轉染試劑,在無動物來源的培養基中,將包含SARS-CoV-2 棘突蛋白的DNA序列的pXLG-6載體轉染CHOExpressTM細胞。該載體包括用于嘌呤霉素抗性標記物的表達盒。轉染后的細胞用嘌呤霉素進行篩選,對于wuhan突變毒株,采用德國 cytena 的 f.sight 單細胞打印機篩選單克隆細胞株。將高水平表達的三聚體S蛋白和RDB單體的細胞株擴增并凍存。RBD棘突片段的重組細胞系和三聚體S蛋白的克隆細胞系在優化的補料分批工藝中,以0.2-,10-和50-L的生物反應器中放大培養。
從300個單克隆衍生的細胞群中,挑選出三聚體棘突(trimeric spike)和受體結合域(RBD)表達水平最高的細胞群進行擴增,并開發了補料分批生產工藝。生產過程逐步擴大到200mL搖瓶、10L和40L攪拌槽生物反應體系。活細胞密度(VCD)和存活率可保持高達10天(圖3)。觀察到三聚體棘突蛋白和RDB單體在各種培養規格下最終收獲滴度均為數百毫克/升。
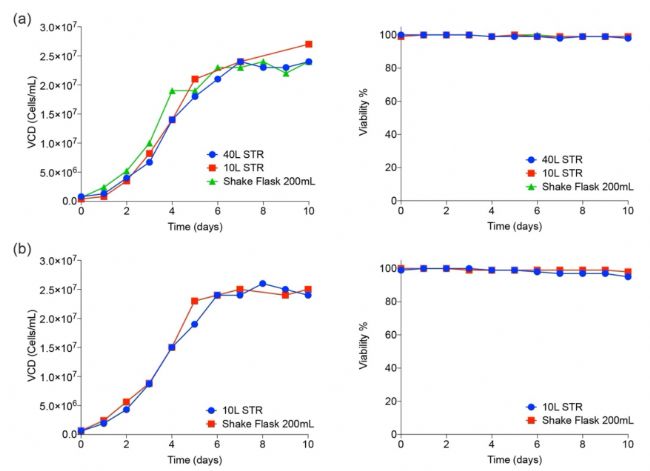
Figure3. Cell culture scale-up performance in shake flasks and bioreactors.
三聚體棘突(a)和RBD(b)的活細胞密度(細胞/mL)和活細胞(%)。
SARS-CoV-2的棘突蛋白對SARS-CoV-2感染的抑制作用
將SARS-CoV-2病毒與連續稀釋的RBD或三聚體棘突混合,并將混合物接種到Vero E6細胞上。48h后發現RBD棘突片段和三聚體棘突的存在減少了Vero E6細胞的感染。表明CHO產生的三聚體棘突和RBD能夠與SARS-CoV-2競爭與宿主細胞的結合。在614D(武漢)和D614G三聚體棘突變體之間未觀察到差異[2]。
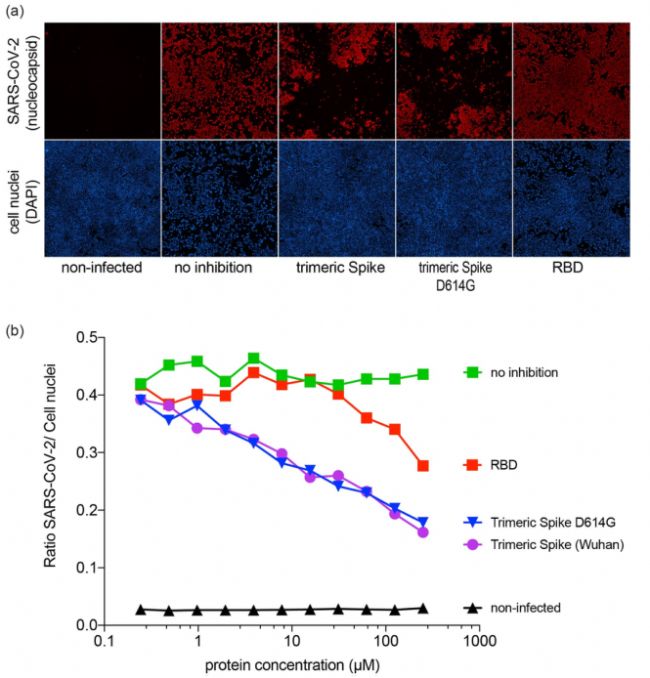
圖4. CHO產生的三聚體棘突和 RBD可抑制SARS-CoV-2感染
(a)三聚體棘突和RBD對Vero E6細胞感染的抑制作用,
病毒核衣殼抗原染色(紅色),細胞核染色(藍色);并對其進行統計分析(b)。
SARS-CoV-2棘突蛋白檢測抗體的敏感性和特異性
我們特別選擇了一組2019冠狀病毒疾病血清樣本,這些樣本涵蓋了大量SARS-CoV-2特異性抗體濃度。通過對三聚體棘突蛋白和RBD蛋白用于血清學分析中檢測SARS-CoV-2特異性IgG。發現新冠病毒樣本的中值信號強度比對照樣本高400倍以上(圖5a)。統計分析顯示,S1單體和兩種RBD的ROC之間沒有差異,武漢和D614G三聚體棘突之間也沒有差異。此外,我們的結果表明,CHO產生的三聚體棘突比S1單體和RBD具有更高的診斷特異性和敏感性。
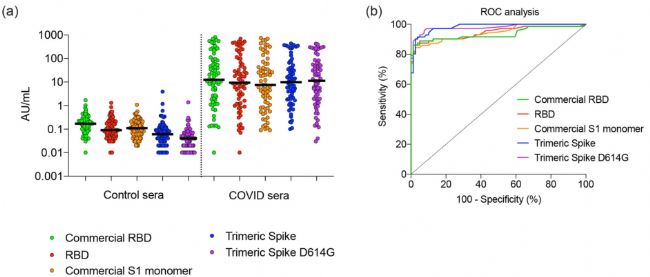
圖 5. CHO產生的三聚體棘突具有更高的診斷特異性和敏感性
(a)在癥狀出現的第4-40天收集的對照血清(n=151)
和 2019冠狀病毒疾病血清(n=72)進行了測試,
并比較了免疫球蛋白G的濃度。(b)用 ROC分析(a)中檢測的血清。
Cytena單細胞打印機溫和篩選的原理保證了CHO具有較高的活性,為下游的擴展生產工藝奠定了基礎,以提供足夠數量的具有哺乳動物型糖基化的三聚體SARS-CoV-2棘突蛋白。功能分析表明,三聚體SARS-CoV-2棘突蛋白能夠有效地阻斷病毒的傳染性。此外,三聚體棘突對SARS-CoV-2特異性IgG的診斷性能超過RDB和單體S1蛋白。
參考文獻:
[1].Kirtipal N , Bharadwaj S , Kang S G . From SARS to SARS-CoV-2, insights on structure, pathogenicity and immunity aspects of pandemic human coronaviruses[J]. Infection Genetics and Evolution, 2020, 85:104502.[1] Kirtipal N , Bharadwaj S , Kang S G . From SARS to SARS-CoV-2, insights on structure, pathogenicity and immunity aspects of pandemic human coronaviruses[J]. Infection Genetics and Evolution, 2020, 85:104502.
[2]. Pino P , Kint J , Kiseljak D , et al. Trimeric SARS-CoV-2 Spike Proteins Produced from CHO Cells in Bioreactors Are High-Quality Antigens[J]. Processes, 2020, 8(12).Pino P , Kint J , Kiseljak D , et al. Trimeric SARS-CoV-2 Spike Proteins Produced from CHO Cells in Bioreactors Are High-Quality Antigens[J]. Processes, 2020, 8(12).
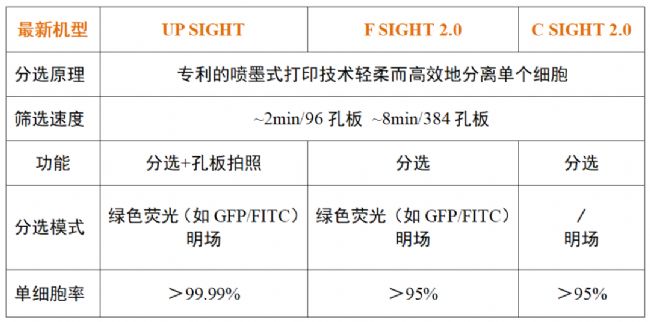
關于Cytena公司
Cytena公司潛心研究單細胞打印機技術多年,不斷升級設備功能,以一貫溫和的分選原理、更加快速的分選效率、更加簡易的操作步驟,助力抗體、細胞治療、基因治療、干細胞等研究領域的客戶快速搭建單細胞篩選平臺。艾貝泰生物科技有限公司作為Cytena的單細胞打印機總代理商,為您提供最優質的售前售后服務。

咨詢請聯系👇👇👇
電話:400-8816-128
郵箱:biotech@applitechpharma.com





