Isoplexis 單細胞蛋白組技術助力加速免疫治療項目臨床前研發
免疫療法已被證明是一種很有前途的治療方法。但由于免疫相關的潛在的嚴重不良反應,使許多研究人員依賴小鼠模型來獲得對于研究的治療產品或療法進行更深入的了解。從早期研發到臨床的整個過程中,IsoPlexis的單細胞解決方案一直在這方面幫助研究人員,通過體外實驗獲得與體內活性相關指標。
通過檢測每個細胞同時分泌多個細胞因子的能力,即細胞的多功能性,檢測最有效的細胞亞群進而建立這種聯系。對于單細胞多功能檢測,允許研究人員發現臨床前發展的新機制,并加速他們的研究。相比于傳統的動物模型實驗有著很大的優勢。
IsoPlexis單細胞蛋白組技術使用了一種綜合的評價標尺——細胞多功能指數(PSI),對細胞的功能進行表征。PSI作為單細胞功能生物標志物的新標準,可以幫助研究人員加速他們的免疫治療項目。
這個新解決方案運行在IsoLight、IsoSpark和IsoSparkDuo系統上,與之配套的是通用的IsoCode芯片,一張芯片可分離500-1500個單細胞,進行單細胞培養,檢測細胞的分泌蛋白。獨特的條形碼技術可同時檢測一個細胞分泌的的多達32個細胞因子。這使得研究人員能夠深入研究細胞的功能。
IsoPlexis新的解決方案加快體內實驗及研發進程
使用小鼠模型進行體內研究可能需要幾周的時間,而使用IsoPlexis平臺的研究人員可以更快地得到結果。我們來看一下兩個相關的應用案例。
多功能GPC3CAR-T治療鼠原位肝癌
Glypican3(GPC3)是Wnt依賴性細胞增殖的抗原,在肝癌(HCC)中高表達。2020年在Gastroenterology(IF= 22.682)文章中報道,研究者利用基于人源化YP7(hYP7)和HN3抗體制備CAR-T細胞,靶向GPC3,并評價其功能。
多功能T細胞是T細胞的一個亞群,能夠在單細胞水平上共同產生兩個或多個細胞因子/趨化因子,最近有報道稱它們在臨床環境中與持久免疫反應相關。研究者使用IsoPlexis的單細胞蛋白組技術對制備的CAR-T進行了功能評價。使用能夠同時檢測32中關鍵的T細胞免疫因子的芯片對CAR-T細胞分泌的細胞因子進行檢測,比較了CAR(HN3)T細胞或CAR(hYP7)T細胞的多功能性,與Mock對照組相比,CAR(hYP7)T細胞能夠分泌多種因子的細胞比例更高,表現出更強的多功能性,提示可能有著更強的功能、更好的治療效果(圖1)。

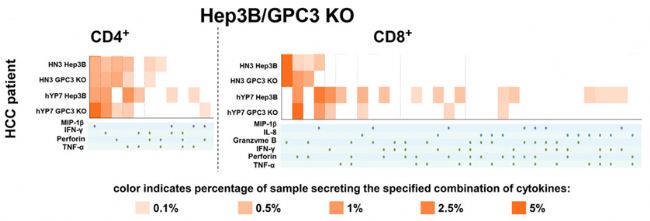 圖1:Heatmap圖顯示hYP7CAR-T細胞中表現出更強的多功能性
圖1:Heatmap圖顯示hYP7CAR-T細胞中表現出更強的多功能性
在之后的小鼠模型實驗中,研究者在NOD/SCID/IL-2Rgcnull(NSG)小鼠腹腔注射表達熒光素酶的Hep3B或HepG2細胞,在腫瘤形成后,小鼠注射生理鹽水或未轉導的T細胞(Mock),或不同劑量的CAR(HN3)T細胞或CAR(HYP7)T細胞。結果顯示,在CAR(HN3)T細胞處理的小鼠中沒有發現明顯的腫瘤生長抑制。接受20M CAR (hYP7) T細胞治療的小鼠在第70天均存活,沒有復發。接受hYP7CAR-T細胞注射的小鼠的治療效果更好(圖2)。
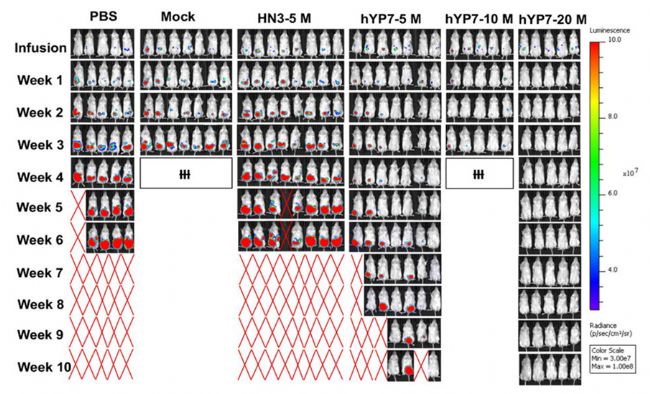
圖2:對照與多種劑量不同CAR-T組效果對比
基于APRIL三聚體(TriPRIL)設計的CAR-T細胞靶向治療多發性骨髓瘤
2019年BloodAdvances雜志上題為《RationalDesign of a Trimeric APRIL-Based CAR Binding Domain Enables EfficientTargeting of MultipleMyeloma》的文章中,研究者發表了基于APRIL三聚體的CAR結合域的合理設計靶向多發性骨髓瘤的研究進展。
在多發性骨髓瘤的治療和研究中,CAR-T細胞治療提供了新的治療路徑,其中靶向B細胞成熟抗原(BCMA)的CAR-T細胞治療是迄今為止最有希望的治療方式,但其療效仍然存在挑戰,因為在單特異性抗BCMACAR-T細胞治療的選擇壓力下,會出現BCMA抗原逃逸變異,從而導致疾病復發,因此仍需要不斷改進CAR-T細胞以改善多發性骨髓瘤的療效。
在這里研究者證實了基于APRIL三聚體的新型CAR(圖3)能有效地靶向BCMA陽性和BCMA陰性的多發性骨髓瘤。雙特異性、基于三聚體APRIL的CAR是一種很有前途的治療多發性骨髓瘤的方法,有可能預防和治療BCMA抗原逃逸。
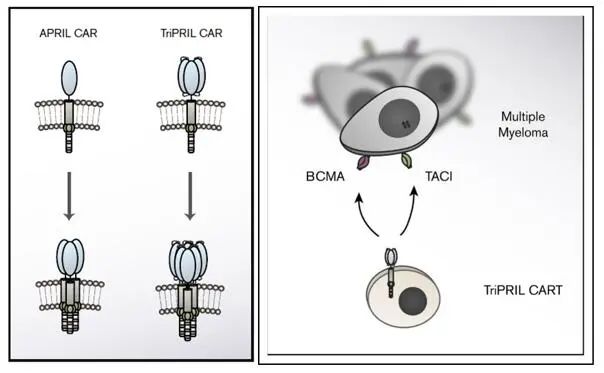
圖3:APRIL和TriPRIL CARs設計
研究者將對照T細胞(UTD)、BCMA、APRIL和TriPRILCAR-T同表達BCMA和TACI的靶細胞一起培養,靶細胞會刺激T細胞分泌細胞因子,使用IsoPlexis檢測32種細胞分泌蛋白的條形碼芯片捕獲T細胞表達細胞因子。相對于其它實驗組,TriPRILCAR-T組細胞中的多功能細胞的比例顯著提高(圖4),單細胞分析表明,CD4+和CD8+T細胞主要分泌效應型細胞因子,在不同的CAR-T中細胞因子分泌譜相似,但分泌頻率有顯著差異(圖5)。
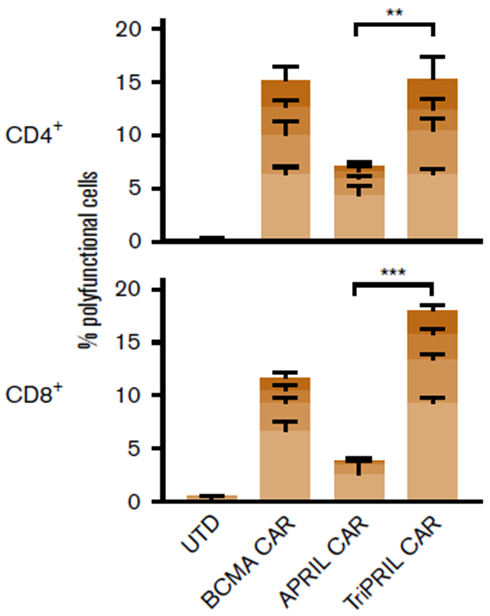
圖4:單細胞蛋白質組學檢測不同CAR-T的多功能細胞比例
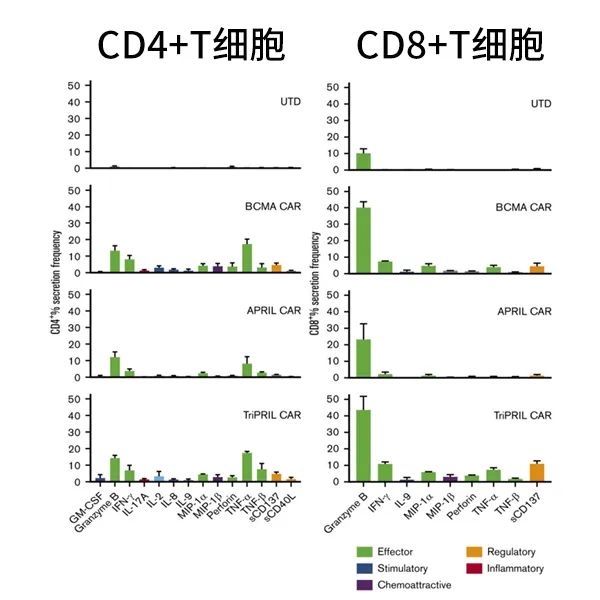
圖5:單細胞水平表征分泌因子圖譜
動物實驗方面,在BCMA陽性小鼠腫瘤模型中,BCAM和TriPRILCAR-T的治療效果都是很好的;在BCMA陰性小鼠腫瘤模型中,因為腫瘤抗原逃逸,只有TriPRILCAR-T取得了很好的治療效果(圖6)。
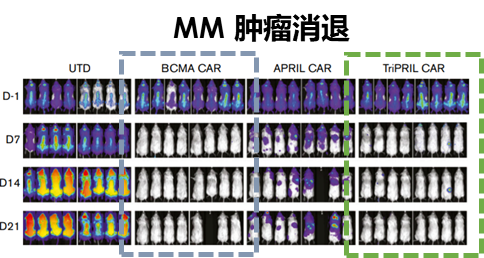

圖6:小鼠實驗結果,TriPRILCAR-T有效靶向BAMA陽性和陰性的多發性骨髓瘤。
SchmidtsA , Ormhj M , Choi B D , et al. Rational design of a trimericAPRIL-based CAR-binding domain enables efficient targeting ofmultiple myeloma - ScienceDirect[J]. Blood Advances, 2019.
總結:

動物實驗動輒需要數個星期,甚至如第一個實驗,需要持續70天;單細胞蛋白組技術在一周內即可完成細胞功能的表征。應用于體內療效相關性分析時,單細胞蛋白組技術體現了以下特點:
2、可以很好的優化研究和藥物研發流程;
3、夠加快體內實驗的進程,節省寶貴的時間;
4、找到關鍵分泌蛋白,指導后續研究。





