利用蛋白質組學揭示新冠潛在新藥治療的分子機制
自去年以來,全球制藥界最艱巨的任務一直集中在制定治療COVID-19的戰略上。迄今為止,已經開發了幾種疫苗,并已證明其在降低COVID-19發病率方面的功效。然而,治療COVID-19的藥物的開發遠遠落后,目前所有的治療方案都有其局限性。SARS-CoV-2引起的炎癥反應涉及多樣化的上游刺激,多種信號通路和眾多下游效應器。因此,靶向任何特定的細胞因子甚至信號通路可能不足以緩解嚴重COVID-19(即細胞因子風暴)中免疫系統的全身過度反應。開發針對炎癥信號級聯中心節點的調節免疫反應方法是緊迫和關鍵的。
2022年2月2日,來自北京大學肖瑞平團隊,中國醫學科學院秦川團隊和西湖大學郭天南團隊合作在 Signal Transduction and Targeted Therapy(IF 18.187)上發表題為“sRAGE alleviates SARS-CoV-2-induced pneumonia in hamster”的研究文章,該研究明確了可溶性晚期糖基化終產物受體sRAGE對于SARS-CoV-2誘發倉鼠肺炎的緩解作用,并借助蛋白組學深入解析了sRAGE抑制肺炎癥狀、緩解器官損傷的分子機制,為sRAGE治療COVID-19的臨床使用提供了強有力的實驗證據和理論支持。
研究材料
倉鼠,肺組織
技術路線
· 步驟1:sRAGE治療SARS-CoV-2肺炎的效果分析;
· 步驟2:蛋白組學揭示sRAGE治療響應的蛋白質組變化;
· 步驟3:功能分析揭示sRAGE治療COVID-19中介導的信號通路途徑。
研究結果
1. sRAGE干預有效緩解SARS-CoV-2誘發的肺炎
晚期糖基化終產物受體(RAGE)是一種多配體促炎模式識別受體,與感染性和無菌性炎癥有關。可溶性RAGE(sRAGE)是一種剪接變體或翻譯后切割的RAGE的短形式,缺乏跨膜和細胞內C端結構域,充當誘餌受體可減弱由全長RAGE引發的炎癥反應。
本研究首先通過SARS-CoV-2接種對倉鼠造成嚴重肺炎,之后用sRAGE進行干預處理。結果顯示sRAGE處理組肺泡間隔彌漫增厚,多灶性滲出以及肺血管周圍和支氣管周圍間隙中炎癥細胞的積累顯著降低;嚴重間質性肺炎倉鼠發病率顯著降低。免疫組織化學染色表明發現sRAGE治療抑制SARS-CoV-2誘導的CD3陽性T細胞募集,粘液病毒抗性蛋白1(Mx1)在肺中的表達也大大降低。qRT-PCR表明sRAGE治療顯著抑制巨噬細胞標志物CD68,炎癥性疾病標志物(包括IFIT3和Mx1),以及炎癥細胞因子(包括IL-1β,IL-6,TNF-α,IL-18和IL-10)的表達。上述結果證實,sRAGE可有效抑制SARS-CoV-2引發的肺炎。

圖1 sRAGE治療緩解SARS-CoV-2引發的肺炎
2. sRAGE干預治療前后肺組織蛋白質組學分析
研究人員對SARS-CoV-2感染組,sRAGE治療干預組及對照組倉鼠肺組織進行TMT標記蛋白質組學分析。結果發現sRAGE治療抑制了SARS-CoV-2感染上調546個蛋白中的408個的表達(74.7%)。通過Reactome和KEGG分析發現在SARS-CoV-2感染時,大多數參與炎癥和DNA復制的上調蛋白在sRAGE處理后下調。
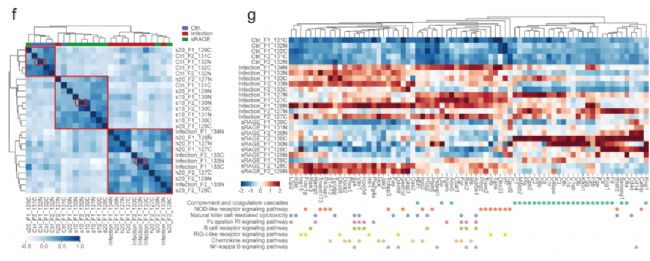
圖2 sRAGE干預治療后的蛋白組學分析
3. sRAGE治療抑制SARS-CoV-2感染引起的多種炎癥信號通路和細胞周期/死亡相關途徑
SARS-CoV-2的感染在肺部引發了深刻的炎癥反應,正如多種炎癥相關蛋白的上調所證明的那樣,而這些變化中的大多數通過sRAGE治療得到改善。對蛋白質組學數據進行深入分析發現,感染誘導的NF-κB、p38、JAK/STAT、Toll-like受體等信號傳導通路的改變被sRAGE抑制。此外,與炎癥信號傳導相關的其他升高蛋白質,包括Cdk7,Ddx58,Dock2和Ifih,也通過sRAGE治療恢復。綜上所述,用sRAGE治療抑制了病毒引發的多條炎癥信號通路。此外,SARS-CoV-2感染誘導的細胞周期/死亡相關途徑的激活也通過sRAGE治療得到緩解。這表明sRAGE治療改善了SARS-CoV-2感染引起的全身組織損傷。

圖3 sRAGE可抑制病毒感染引發的炎癥和細胞死亡等信號通路
小編小結
本研究通過倉鼠模型發現sRAGE能顯著緩解SARS-CoV-2誘導的肺炎和器官損傷,之后借助蛋白組學技術系統解析了sRAGE干預治療SARS-CoV-2肺炎的分子機理:抑制病毒誘導的炎癥信號通路和細胞死亡相關通路。本研究證明了sRAGE治療COVID-19的臨床應用潛力,為新冠肺炎治療提供了新的策略。
中科優品推薦
【中科新生命】提供蛋白質組、修飾蛋白質組等多種組學檢測服務,作為前中科院上海生科院蛋白質研究分析中心,具有超17年項目經驗積累,提供最完整、最可靠的組學技術服務,創新引領前沿技術發展。歡迎感興趣的老師前來咨詢。






