經典模型案例之腫瘤細胞的擴增與異質性解析
3個腫瘤異質擴增模型
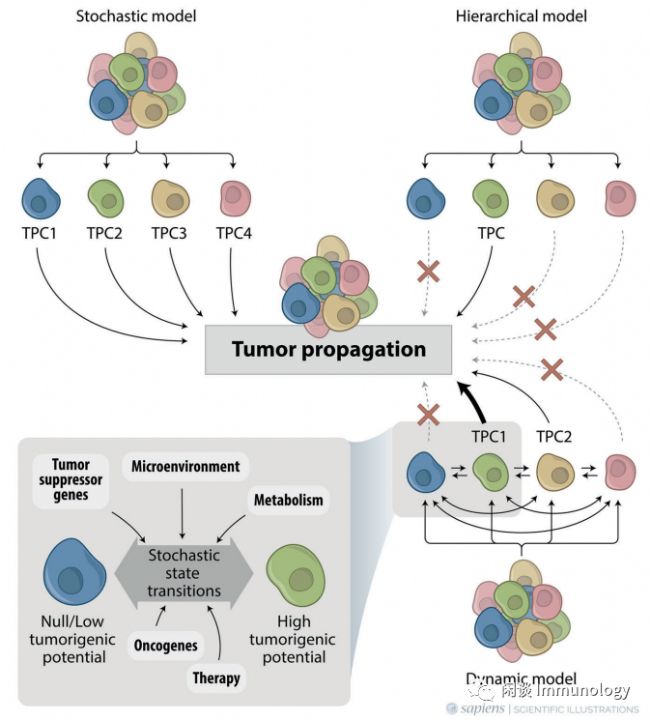
1. 克隆進化隨機模型(stochastic model)
在隨機模型中,所有的腫瘤細胞都是等效的,即它們都可以自我更新并產生不同的子代,它們的行為是由內在變量和外在變量隨機決定的。
一些進化觀點
非線性的、分支進化模式,即癌細胞共享腫瘤進化歷史早期發生的基因改變,隨后在亞克隆群體中逐漸積累新的驅動突變。
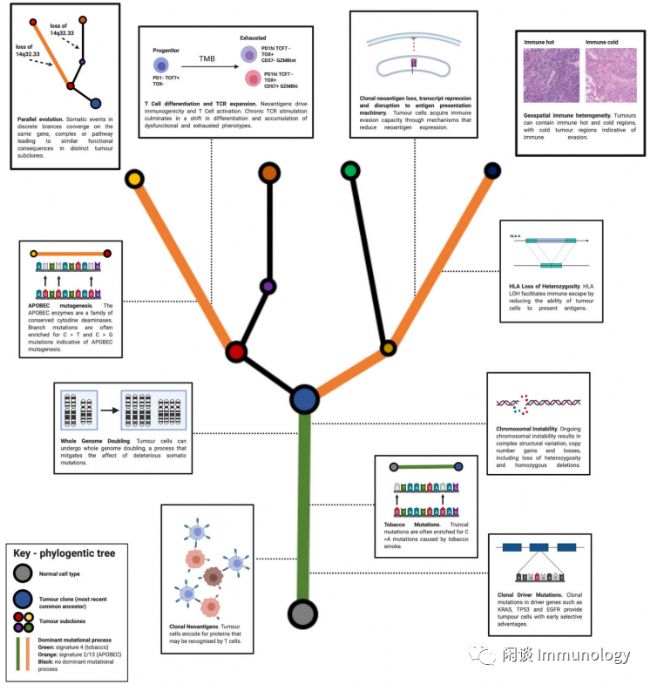
間斷的進化形式,即大量的基因組畸變在短時間內發生,在癌癥進展的早期階段產生較高的腫瘤內異質性。
表觀遺傳差異為腫瘤內的異質性增加了另一層復雜性,它們可以誘導腫瘤內基因表達的顯著改變。
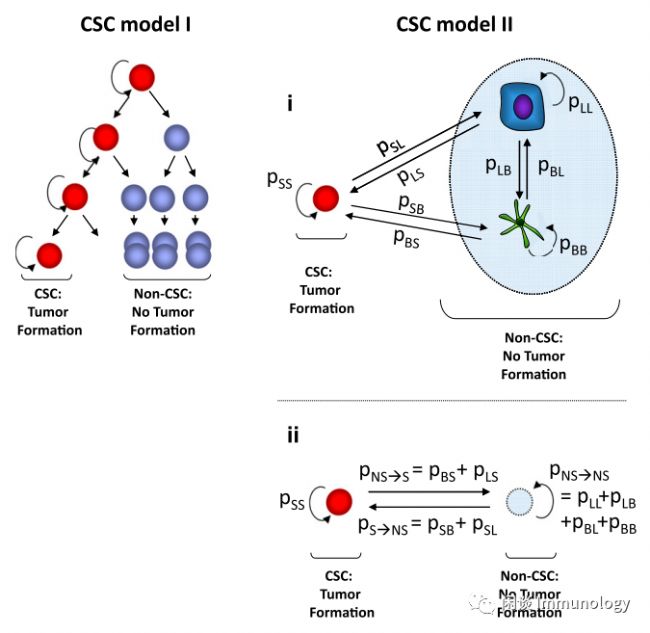
2. 癌癥干細胞分層模型(hierarchical model)
癌癥干細胞模型中,認為癌癥細胞中只有一小部分腫瘤細胞,表達干細胞的標志物,被稱為癌癥干細胞(Cancer stem cells, CSCs),具有自我更新潛能,能夠產生表型多樣的細胞,從而以明確的分層模式維持腫瘤生長。分層的意思是,只有CSCs可以擴增產生子代細胞,其他癌癥細胞不可以。
隨機模型和癌癥干細胞模型并不一定相互“排他”,因為:(i)癌細胞可以在致瘤性標記物高表達和低表達的狀態之間相互轉換。(ii)CSCs并不一定來源于組織干細胞,而且致瘤性也不只存在于表達干細胞標記物的癌細胞中。癌癥干細胞和非癌癥干細胞之間可以相互轉化。
3. 可塑性動態模型(Dynamic Model)
腫瘤內異質性的另一個關鍵因素是細胞可塑性,即特定細胞改變其身份和獲得其他細胞類型特征的能力。
顯然上述三個模型都各有特點,但是都有局限性。綜合三者的特點,提出“腫瘤擴增細胞”(Tumor propagating cells,TPCs)的概念。
腫瘤擴增細胞
(Tumor propagating cells,TPCs)
“腫瘤擴增細胞”(Tumor propagating cells,TPCs)是指負責腫瘤進展,并能夠在連續移植試驗中傳播癌癥的癌細胞,在組織學上是異質性的,并再現了原發腫瘤的關鍵組織病理學特征,如浸潤/遷移和多譜系分化。TPC表型是一種動態表型,非TPC腫瘤細胞可以通過狀態轉變獲得。
使用細胞表面標記物來區分TPCs和非TPCs,仍然是比較來自腫瘤的不同癌細胞之間的致瘤性的最直接(和可接近)的方法。但是使用細胞表面標記物來分離和比較不同癌細胞之間的致瘤潛力可能并不成功。TPC的真正特征只能通過腫瘤的擴增能力來評估。
Oncogene . 2020 Mar;39(10):2055-2068.
腫瘤擴增潛力獲取和維持
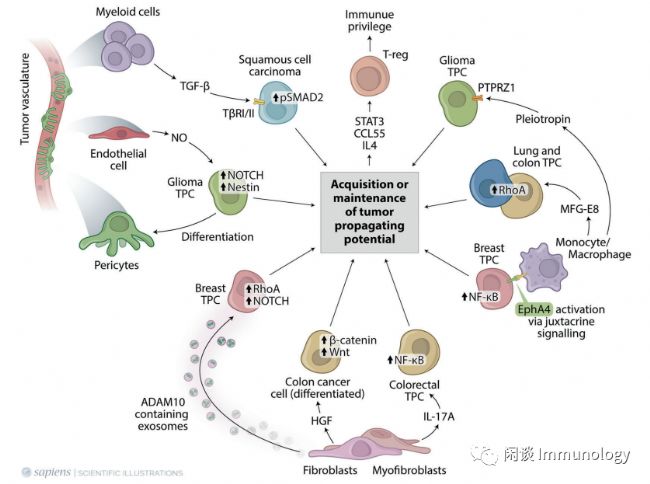
神經膠質瘤,TPC狀態受到多個通路調控。
1)Notch通路的調節
2)巨噬細胞分泌的Pleiotropin驅動PTPRZ1激活
3)STAT3-Hedgehog通路。
乳腺癌細胞,TPC狀態受含有ADAM10外泌體調控,該外泌體由成纖維細胞分泌,激活腫瘤細胞中的Notch和RhoA通路;TPC與單核/巨噬細胞相互作用并激活NF-κB,分泌維持TPC狀態的細胞因子。
肺癌和結腸癌,TPC狀態受到巨噬細胞分泌的MFG-E8的調控。結腸癌TPCs可通過肌成纖維細胞分泌的HGF激活β-catenin/Wnt通路來維持。結直腸癌TPCs通過NF-κB激活、STAT3和Hedgehog通路來維持。
鱗狀細胞癌,TPC狀態通過轉化髓系細胞分泌的TGF-β來調節,該因子與其受體(TbRI/II)結合,激活SMAD2。
主要參考文獻
-
Alexandre Teixeira Vessoni et al,Tumor propagating cells: drivers of tumor plasticity, heterogeneity, and recurrence,Oncogene . 2020 Mar;39(10):2055-2068.
-
Chris Bailey et al,Tracking Cancer Evolution through the Disease Course,Cancer Discov. 2021 April 01; 11(4): 916–932.
-
Piyush B. Gupta et al,Stochastic State Transitions Give Rise to Phenotypic Equilibrium in Populations of Cancer Cells,Cell 146, 633–644





