新型水凝膠搭載抗炎藥物與生長因子,加速SCI創口愈合促進軸突再生
脊髓損傷(spinal cord injury, SCI)是對脊髓造成的暫時性或永久性的功能性損傷,常見的癥狀包括肌肉、感覺或自主神經功能的喪失。
在嚴重的SCI后,神經炎癥失調會導致神經元和神經膠質細胞凋亡,在傷口愈合過程中形成疤痕和空腔,并最終形成抑制神經再生的萎縮性微環境。由于涉及到復雜和動態的病理生理學情況,少有通過微環境重塑實現無疤痕和無腔傷口愈合從而促進神經再生的系統解決方案。2021年7月10號,來自于浙江大學醫學院的研究團隊。在Advanced Healthcare Materials上發表了題為Rationally Designed, Self-Assembling, Multifunctional Hydrogel Depot Repairs Severe Spinal Cord Injury的文章,研究團隊研發了一種新型水凝膠,搭載抗炎藥物MPSS和GFs,促進瘢痕邊緣和空腔愈合,可顯著促進軸突再生。

▲論文圖
研究結果分析
01首先,研究團隊設計并制作了水凝膠
為了填補SCI后不規則的病變區域,研究團隊設計了一種可注射、可搭載各種治療劑的自組裝凝膠(HD)。該水凝膠具有親水性、蛋白粘性以及增加細胞間的相互作用等特性。測定水凝膠凍干樣品在2個月內質量損失,結果發現在SCI慢性期后注射該水凝膠可支持細胞遷移。同時,溶脹研究結果發現,該水凝膠適合注射到SCI部位,不會引起注射后的二次損傷。
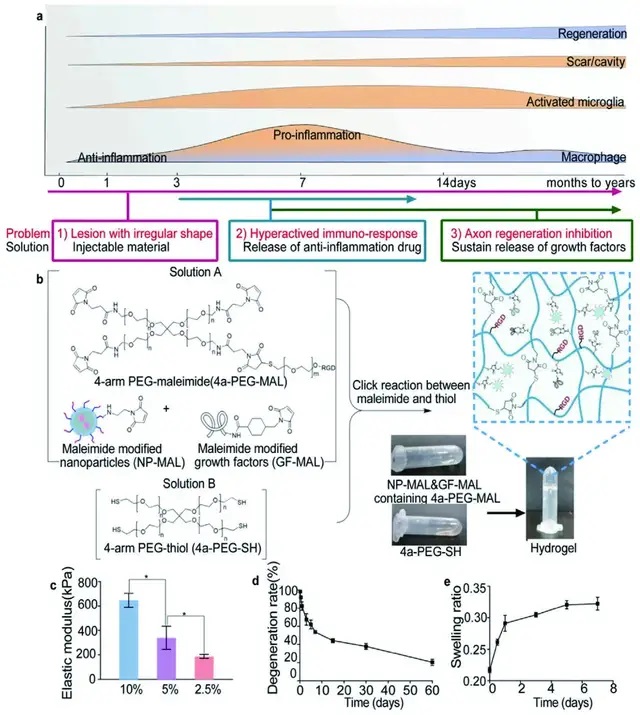
▲Fig. 1.1
02抗炎藥物與生長因子釋放曲線的優化
為了改善SCI急性期產生的炎癥,研究人員將抗炎藥物MPSS包埋進納米顆粒(NPs)中,將藥物釋放時間延長至幾天,保證抗炎藥物在急性期內發揮最大功效。結果顯示,傳統沒有納米顆粒材料搭載的情況下,MPSS釋放時間約為2天;而有納米顆粒材料搭載的MPSS釋放時間長達4-7天,可覆蓋SCI急性期。
利用點擊化學方式將生長因子(GFs)綴合到水凝膠中,釋放時間可長達1個月,在SCI慢性期可為神經再生提供有力的支持。評估生物相容性的結果顯示,在水凝膠培養基中培養的細胞與在常規培養基中培養的細胞活力相當,表明水凝膠具有生物相容性,細胞毒性低。
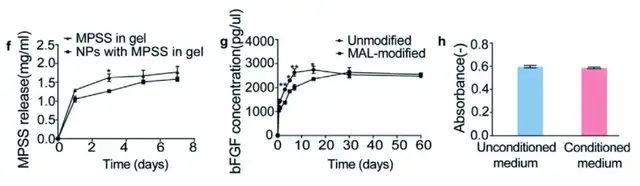
03僅使用生長因子的水凝膠不足以完全防止空腔和瘢痕邊界形成
生長因子如BDNF,可顯著提高SCI后神經元的存活率,研究團隊進一步探究了水凝膠僅緩釋生長因子是否會優化神經元/組織的保護效果。首先,使用RWD 68099II 打擊器,對大鼠T10節段采用打擊速度2m/s,深度2 mm,停留時間為5 s的打擊方案來模擬臨床SCI 。SCI損傷后的大鼠BBB評分為 0 到 2,說明幾乎無軸突存活。
實驗組(G-HD)在SCI一周后的損傷部位注入搭載BDNF、VEGF以及bFGF的水凝膠,對照組注入PBS溶液。8周后,3D圖像量化結果顯示 G-HD 組的空腔體積約為對照組的一半,不規則病理組織的體積增加了一倍,殘余組織量相比對照組也顯著增加。然而G-HD組在宿主/材料界面處仍然形成GFAP+“墻”,可能是因為 G-HD 組并沒有減輕脊髓炎癥反應。即單獨使用水凝膠長期釋放生長因子可以支持神經元/組織存活,但不能完全防止空腔和瘢痕邊界形成。

▲Fig. 2
04搭載抗炎藥的水凝膠幾乎可以完全防止空腔形成,但無法抑制瘢痕的形成
由于生長因子無法有效阻礙空腔形成,研究團隊嘗試通過延長抗炎藥物釋放時間,緩解脊髓炎癥反應,從而防止空腔形成。將MPSS(M-HD組)和納米顆粒搭載的MPSS(MP-HD組)分組注射在患處。對比發現,MP-HD組的空腔體積僅為M-HD組的1/7,MP-HD組幾乎可以阻止空腔形成。損傷處下方的NF+ 軸突密度是對照組的兩倍。由于 MP-HD 組幾乎可以完全防止 SCI 后空腔形成,通過評估空腔的體積和剩余軸突的數量來確定介導過度活躍的神經炎癥以防止空洞形成的最佳時間窗口。結果表明SCI 后 3-7 天可能是調節失調的神經炎癥和保護神經元/組織的最佳時間窗口。
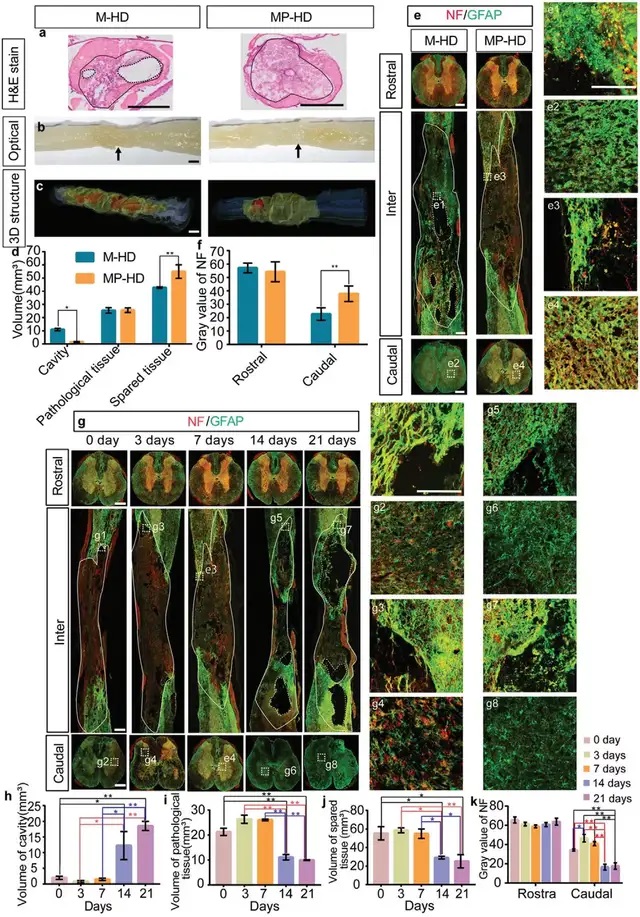
▲Fig. 3
05水凝膠協同釋放生長因子和抗炎藥物,促進神經再生
盡管 MP-HD 組幾乎完全阻止了空洞的形成,但疤痕邊界仍然抑制了受損軸突的再生。研究團隊推測,除了抗炎藥外,提供神經營養因子可能會促進神經元/組織的存活并減弱瘢痕的形成。在損傷后第 7 天,將含有MPSS裝載的NPs和GFs的水凝膠(MPG-HD)注射到損傷部位。與 MP-HD 組相比,MPG-HD組幾乎完全阻止了空腔的形成并保護了大量幸存的組織/軸突免受二次損傷,致密的GFAP+“墻”在MPG-HD介入后基本消失,新生一些較松散的結構,可能是因為生長材料促進了細胞存活并增強了材料和宿主組織的整合。MPG-HD組伸入病灶 2 mm 的 NF+ 軸突數量增加了兩倍但這些軸突并沒有延伸到損傷部位的中心。總的來說,MPG-HD治療挽救了一些幸存的軸突免于繼發性損傷,并為軸突再生建立了一個可能的環境,即使這些軸突沒有穿過損傷部位。
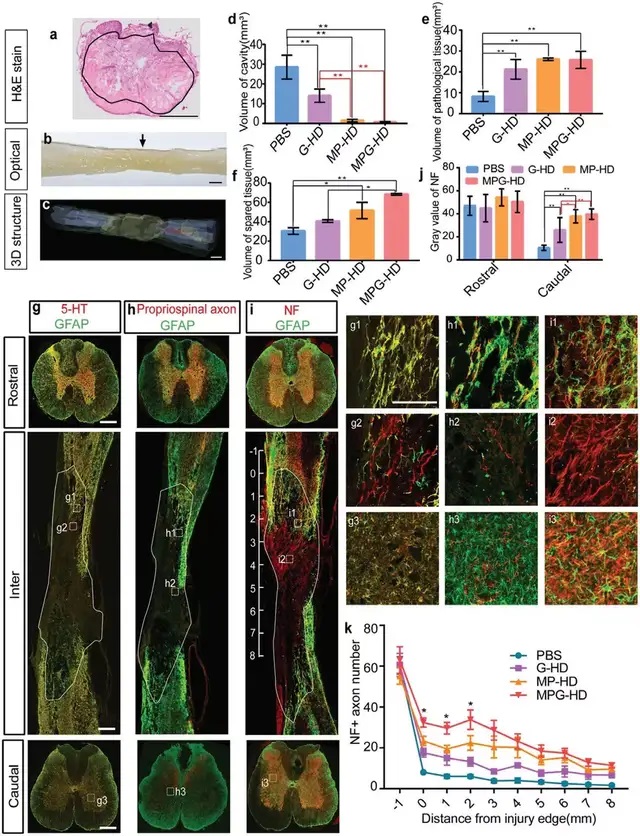
▲Fig. 4
06MPG-HD 治療通過 ECM 重塑促進神經再生
研究團隊進一步探究了MPG-HD防止空腔/瘢痕邊界形成并促進神經再生的機制。
橫向脊髓切片的 GFAP 和纖連蛋白 (FN) 染色表明,PBS對照組動物中形成的空腔大部分被 FN+ 基質填充。MP-HD 和 MPG-HD組的脊髓中的 Iba1 和 CD68 免疫反應強度顯著降低至與完整組織相當的水平,表明 MP-HD 和 MPG-HD 成功將炎癥誘導的神經毒性調節至正常水平。僅在 MP-HD 或 MPG-HD 治療后在損傷中心區域觀察到更多的神經元和髓鞘,表明 MP-HD 和 MPG-HD 治療后防止了軸突切斷的脊髓神經元和少突膠質細胞的死亡。在MPG-HD 組中神經元、成纖維細胞、少突膠質細胞和內皮細胞的比例有所增加,表明 MPG-HD 有助于組織保護和 ECM 形成;另一方面,炎癥相關細胞的比例有所減少,表明 MPSS 的釋放可以抑制 SCI 后的神經炎癥;同時,負責在受傷和完整組織之間形成屏障的小膠質細胞的比例呈下降趨勢。
研究人員進一步關注了在SCI傷口愈合過程中發揮抗炎和促炎作用的巨噬細胞,MP-HD 和 MPG-HD注射后抗炎巨噬細胞比促炎巨噬細胞多,且在MPG-HD注射條件下抗炎基因表達增加,促炎基因表達下降。此外,與傷口愈合、髓鞘、ECM、膠原蛋白和 GF 結合以及細胞粘附相關的基因表達在MPG-HD組比PBS對照組中顯著富集。這些結果表明MPG-HD治療優化了ECM形成并促進組織保護。
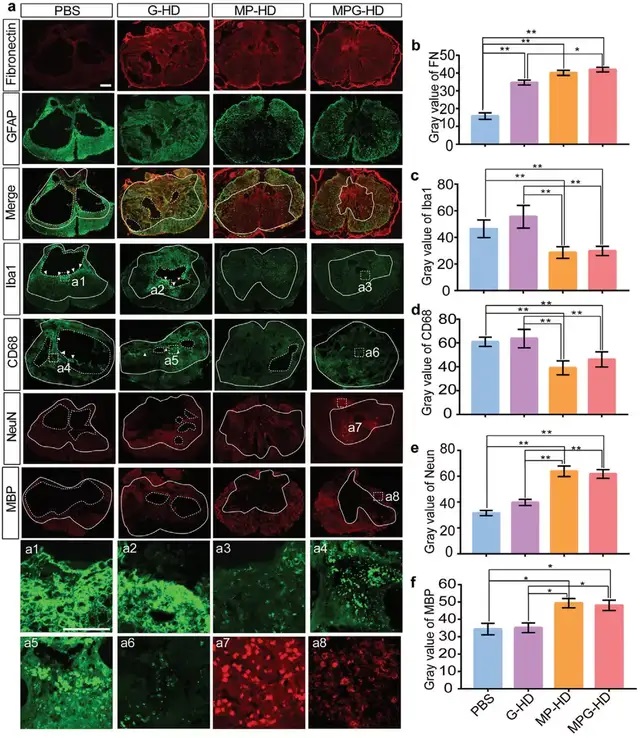
Fig. 5
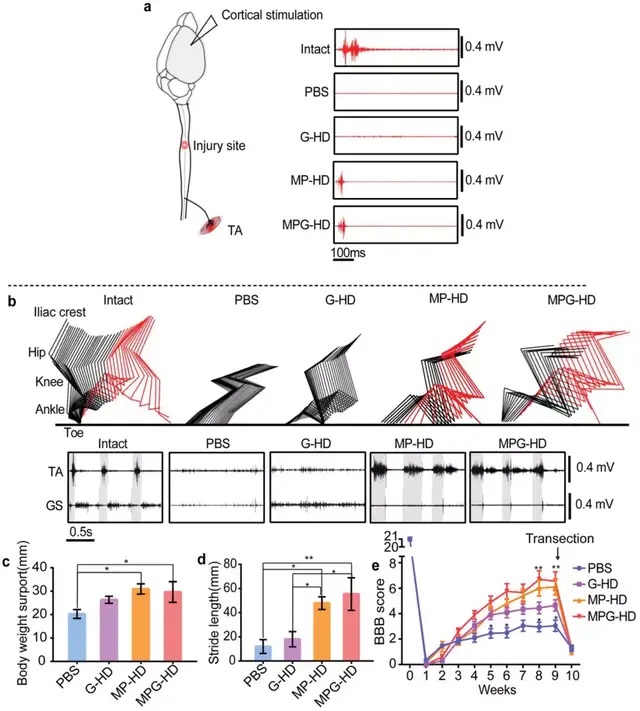
07水凝膠通過治療幸存軸突而非再生軸突來促進功能恢復
在功能和行為方面,第5 周時,G-HD 組大鼠可見明顯的踝關節運動,并在注射9 周后達到功能平臺。MP-HD 組7周后大鼠可見足底踏地和負重步行,表明 MP-HD 治療具有防止空腔形成和保護備用幸存組織/軸突的能力。然而,與 MP-HD相比,MPG-HD 治療未能進一步改善功能恢復,表明 MPG-HD 治療誘導的再生軸突不能自發發揮功能。
08殘留的軸突支配損傷部位下方的脊髓并介導功能恢復
為了確認殘余的軸突重新支配了損傷部位下方的脊髓神經回路,使用肌電圖 (EMG)評估從中樞神經元到外周神經元的連接。將刺激電極放置在后肢運動控制區的皮質上,并監測踝屈肌的EMG活動,發現僅在 MPG-HD 組的動物中觀察到踝屈肌的EMG 活動,但幅度小于未損傷動物的幅度。為了進一步確認功能恢復是否依賴于殘留的神經元回路,研究人員將脊髓損傷部位重復橫斷,一周后后肢功能改善完全消失,該結果表明,功能恢復是由剩余的軸突依賴性神經元回路介導的。
展望
在本研究中,再生軸突不能穿過病變部位到達運動功能束。理想情況下,具有精確線性陣列的自組裝支架可以幫助軸突經由脊髓病變部位向適當的目標區域再生,但是目前還沒有這種技術。在未來的研究中,原位 3D 打印技術可能能夠在脊髓病變上創建精確、高保真的線性陣列。即使損傷的軸突可以在病變處生長,它們可能仍然難以觸及靶點,并且它們可能需要依賴于使用可塑性來形成中繼電路并整合到功能網絡中。
瑞沃德68099II精密打擊器是一款用于顱腦和脊髓損傷造模的儀器,采用氣動-電動控制,可精準調節打擊速度、打擊深度以及停留時間,實現精準打擊。






