Digital Western Blot在領先靶向蛋白降解藥物公司研發中應用
蛋白表達和功能異常調控可極大地改變細胞生理學并導致許多病理生理狀況如癌癥、炎癥性疾病和神經退行性疾病等。內源性蛋白質的穩態表達由從頭合成和降解速率的平衡來控制。靶向蛋白質降解(Targeted Protein Degradation,TPD)以劑量和時間依賴性方式通過蛋白酶體對致病靶蛋白進行降解。從目前藥物研發進展來看,靶向蛋白降解的概念提供了革命性的藥物開發機會,預計將帶來現代小分子藥物研發的轉變。
在靶向蛋白降解領域,蛋白質免疫印跡技術(Western Blot,WB)是觀察細胞中濃度依賴性蛋白質降解的經典方法。然而,傳統的蛋白質印跡非常耗費資源,需要多個洗滌步驟和長孵育時間才能產生高質量的印跡,導致技術操作復雜、通量低、定量不準和重復性差等劣勢,難以推動選擇性誘導、快速和可持續性的蛋白質降解療法的快速發展。
根據藥物研發需求,工業界迫切需要建立高效、靈敏、可量化和可重現的蛋白質降解技術平臺,滿足不同通量和不同研發階段需求。目前全球領先的靶向蛋白質降解藥物研發公司基本建立了高低通量結合、篩選和驗證一體化的研發平臺。下面文章一窺行業領先的藥物公司平臺建設思路。
SLAS Discovery:C4 Tx團隊總結加速靶向蛋白降解療法開發和優化的高通量技術
本文總結了靶向蛋白降解領域最常采用的從低通量到高通量的幾種不同方法。詳細說明了傳統Western blot、基于毛細管電泳技術的Digital Western Blot(ProteinSimple)、高通量流式細胞術(HTFC)、AlphaLISA SureFire技術、時間分辨熒光共振能量轉移(TR-FRET)技術和Nano-Glo HiBiT技術。
Digital Western Blot技術
Digital WB技術是傳統WB實驗系統的高效替代方案。使用該技術,可在同一根毛細管中完成樣品分離、捕獲、固定、免疫檢測和定量分析,從而實現傳統WB的所有實驗步驟(包括蛋白質上樣、分離、免疫印跡、洗滌、檢測以及數據分析)自動化,有效提高蛋白質表達定量結果的精確性和重復性。全自動Digital WB技術顯著地縮短了樣本檢測時間到3小時,直接采集化學發光或熒光信號值,利用數字化信號峰面積來表征蛋白含量,短時間內實現了目的蛋白的可視化精準定量分析。ProteinSimple旗下具有系列的Digital WB系統,從25到96個樣本通量,可滿足靶向蛋白降解藥物研發過程中對中低通量檢測需求。
本技術可相對和絕對定量檢測目的蛋白豐度,適用于內源性的或未修飾靶蛋白分析,如果抗體表位不受干擾,也可檢測修飾的標記過的蛋白質。與傳統WB相比,Digital WB可實現高分子量蛋白質可靠捕獲和定量分析如BRD4案例。同時,需要樣本量少,只需要3 μL上樣量,特別適用于細胞或降解劑有限的條件下,96孔板中收集處理過的細胞可滿足檢測需求。除了自動化和標準化之外,批次數據差異CV值較低,重復性好。軟件符合21 CFR Part11,數據全程可記錄。這些優勢使其成為工業領域蛋白表達檢測平臺的標準配置。
高通量流式細胞術(HTFC)和In-Cell Western (ICW)
流式細胞技術可分析細胞表面和細胞內蛋白質表達水平,技術進步已使流式可作為中高通量篩選方法來輔助藥物發現。緊湊型流式細胞儀可檢測96孔板中細胞配體或蛋白質的不同熒光強度。本質上,高通量流式細胞術一次檢測單個細胞,提供單個細胞信號。而ICW對孔內所有細胞進行批量讀取。兩種方法使用比率熒光讀數來提高重現性和降低標準偏差,進而提高整體數據質量。與傳統流式比,這兩種技術方案需要更少的樣本體積和檢測抗體可有效降低成本。但無法根據蛋白質分子量參數來區分特異性和非特異性信號。
AlphaLISA SureFire技術
AlphaScreen是一種多功能的基于微珠相互靠近實驗技術,基于生物分子的相互作用,可測定各種分析物包括標記的或內源性蛋白。本技術提高了檢測靈活性,微珠種類被設計識別各種不同的工程化蛋白質標簽,或AlphaLISA每個微珠能包被針對目標蛋白不同表位的特異性抗體。當與同一蛋白質結合時,Alpha供體和受體微珠會靠近,采用680nm近紅外光激發,供體微珠導致單線態氧分子釋放。單線態氧的產生本身不足以產生信號,但當受體微珠靠近時,會引發能量轉移反應,進而產生放大的熒光信號。AlphaLISA SureFire技術采用改進光譜特性的微珠,只能進行終點分析,需要細胞裂解來觀察感興趣蛋白質信號。對于時效性降解曲線,可通過多個高通量篩選細胞培養板在不同時間點裂解來實現。該技術優勢是有助于更快地優化、自動化和小型化,適用于化合物常規和高通量篩選。可減少實際操作時間和信號讀取需要的總時間,加速藥物發現。具有飛克級靈敏度和 4-5 log 寬動態范圍,使其適合于細胞內、分泌或膜結合蛋白檢測。
對于靶向蛋白質降解的細胞學實驗,384孔板可顯著縮短實驗時間。使用合適的抗體,通過使用針對靶蛋白翻譯后修飾的抗體來區分靶標蛋白。例如使用特異性識別磷酸化蛋白的抗體直接評估具有自磷酸化活性激酶的化合物BiDAC抑制和降解影響,可與總蛋白(磷酸化和未磷酸化)測量值進行比較。獲得這兩個數據可能會提高降解劑與抑制劑前體區分機制的理解,進一步了解目標蛋白調節對表型影響。
盡管有這些優點,該技術有一些局限性。Alpha 微珠價格昂貴且對環境光高度敏感,需要在暗室環境添加實驗試劑,上機前孵育期間盡可能避免在光線下長時間暴露。此外,讀板機溫度會影響單線態氧的生成和擴散速率,每攝氏度可高達10%。為了最大限度地減少批次間差異,實驗微孔板和讀板機應保持在溫度良好可控環境中。最后需要注意過渡金屬可導致單線態氧猝滅效應。
時間分辨熒光共振能量轉移(TR-FRET)實驗
TR-FRET實驗可用于檢測細胞內蛋白質水平變化,有助于高效快速的靶向蛋白質降解領域的藥物發現。與AlphaLISA SureFire 技術類似,TR-FRET 是一種直接的均質混合和讀取夾心免疫分析方法,信號檢測前不需多次洗滌步驟。通過量化兩種熒光團標記的抗體之間的比率信號來確定蛋白降解水平,這些抗體結合同一蛋白質上的兩個不同表位,采用供體和受體熒光團標記。
TR-FRET是終點實驗,需要細胞裂解來觀察檢測感興趣蛋白質的信號。如蛋白降解動力學曲線,必須使用多個高通量篩選細胞板并行設計TR-FRET實驗,以便裂解細胞并在每個時間點后添加檢測抗體。將這些數據疊加可提供DC50、Emax偏移以及時效曲線。對于生物標志物分析,重要的是兩種抗體使用不同表位與同一蛋白質結合,以啟用 FRET 信號,同時將背景信號降至最低。與Alpha 技術一樣,該方法可用于測量目標蛋白質翻譯后的抑制,從而可對通路抑制以及總蛋白質水平進行定量。也可區別癌癥樣本突變體和正常組織中相同蛋白質野生型具有選擇性的降解劑。本技術需要購買高質量特異性抗體,長期藥物發現工作時,TR-FRET 分析每個數據點成本可能是該技術的最大缺點,盡管成本可通過批量定制標記抗體降低。TR-FRET實驗的靈活性、適應性和可轉移性具有優勢。一旦針對某個細胞系靶蛋白的 HTRF方法建立,通常很容易轉移到表達相同蛋白質的其他細胞系中。HTRF技術具有寬動態范圍和信號穩定,而無需擔心環境光的猝滅效應。
Nano-Glo HiBiT技術
Nano-Glo HiBiT技術是一種高通量靶向蛋白質降解藥物篩選系統。本技術基于分成兩部分互補NanoLuc熒光素酶系統,11個氨基酸的HiBiT標簽和 17.6 kD LgBiT多肽。采用 CRISPR基因編輯技術將11個氨基酸的 HiBiT標簽引入到編碼目標蛋白基因內,或設計為可通過質粒轉染或慢病毒感染的重組DNA表達載體,兩種方式都可實現將標簽與感興趣目的蛋白相連。加入特有的裂解檢測試劑,HiBiT會自發的與檢測試劑中與HiBiT互補的多肽LgBiT結合,二者結合后可形成有催化功能的NanoLuc 熒光素酶,可催化底物產生明亮的發光信號。該信號強度與細胞裂解物中的 HiBiT 標記蛋白含量成正比。
本技術檢測蛋白質濃度線性范圍有幾個數量級,產生的發光信號可穩定數小時,因此適用于蛋白質降解劑藥物發現階段的高通量篩選。將HiBiT標簽基因編輯敲入到感興趣的蛋白質序列中,并生成穩定表達 HiBiT 標簽目的蛋白的細胞系,整個實驗開發時間至少需要3-4周。如需要挑取高表達HiBiT信號的單細胞克隆,則這個系統開發時間額外增加2-3周。與不需要基因編輯開發表達HiBiT細胞系技術相比,開發時間長是這種方法的一個缺點。然而,一旦產生穩定表達的具有足夠信號的細胞克隆或細胞群,操作只需加樣、直接均勻混合和讀取檢測,比較簡單。
HiBiT 技術也可進行實時動力學蛋白降解檢測。LgBiT蛋白通過慢病毒轉染到已經表達HiBiT標記的目標蛋白細胞中,同時表達HiBiT和LgBiT標簽,整個實驗過程中重組發光NanoBiT酶都存在,通過與特定底物作用來檢測信號隨時間變化值。作為單一的非裂解試劑添加步驟,持續幾分鐘到幾小時到幾天時間內實時測量目的蛋白質降解,所以這種方法檢測板和HiBiT試劑成本方面更具成本效益,但長時間實驗需要配置自動化系統。
靶向蛋白質降解平臺建設策略
縱觀目前市面上幾種不同通量的靶向蛋白質檢測技術,每種技術都各自優勢和相關局限性。如何構建高效的靶向蛋白質降解技術平臺來推動藥物發現計劃,需要注意整體策略選擇,綜合考慮成本、時間和可行性等多種因素。根據具體研發目標,選擇最可能受益技術方案。針對某些靶標蛋白可能需要采用分層篩選漏斗原理,根據C4團隊的經驗,這種分層方法可最大限度地提高數據收集效率,以推動BiDAC降解劑早期發現和優化工作。各種策略前提是針對目標蛋白的抗體,及所有檢測方法和試劑都必須在化合物篩選前完整驗證。如有Nano-Glo HiBiT技術平臺,可作為快速優化降解劑效力的高通量篩選的首選方法,它適用于終點法和連續讀取方法,以與TR-FRET相當的成本,但提供更多的數據類型和檢測靈活性。如有針對目的靶標高度特異性且經過驗證的抗體,同時有相關即用型試劑盒,TR-FRET是一種合適的高通量藥物發現工作的替代方案。TR-FRET可為表達相同目標蛋白的不同細胞系后續篩選提供有吸引力的選擇。具體那種方案作為高通量篩選階段優先選擇,取決于研發階段和目標。
本團隊建議高通量篩選平臺需與其他技術平臺配合使用,才能更充分表征異雙功能蛋白降解劑。如采用Digital WB確認內源性蛋白質降解,以確保與初步篩選實驗中利用HiBiT高通量技術獲得一致性實驗結果,防止初級篩選試驗中數據結果被錯誤解讀。不管首選策略是什么,隨著未來幾年靶向蛋白降解領域的研究不斷加強,利用更高通量技術和更自動化平臺來加速藥物發現是一項有價值的投資
SLAS Discovery:C4 Tx團隊開發一種小分子誘導泛素化動力學檢測方法
目前大多數靶向蛋白降解化合物借助最常見的E3泛素連接酶,主要是Cullin環連接酶CRBN或VHL。化合物在E3連接酶和靶蛋白之間形成三元復合物,并促進E3連接酶催化靶蛋白泛素化,多泛素化靶蛋白隨后被細胞蛋白酶體降解。BiDACs以催化方式驅動靶蛋白泛素化,時間依賴性的誘導靶蛋白持續降解。作為新興的治療策略,理解蛋白質降解的催化基礎對于靶向蛋白質降解表征和效用至關重要。
依賴CRBN雙功能蛋白降解化合物(BiDAC)的催化速率是藥物發現過程中需要考慮的重要參數。C4基于毛細管的全自動數字化WB技術,開發了一種無細胞裂解物泛素化的體外系統來檢測BRD4溴結構域1(BD1)泛素化的動力學。采用全自動Digital WB來進行BD1和BRD4泛素化水平,研究發現 BiDAC 在泛素化速率、親和力和協同性方面存在顯著差異,并遵循快速平衡模式。此外,量化發現不同化合物之間泛素化模式有所不同。本研究提供一個框架來優化BiDAC,進而提高三元復合物形成親和力和泛素化率。只有在形成穩定的靶蛋白-BiDAC-E3泛素連接酶三元復合物時才能高效特異性泛素化靶蛋白,但三元復合物形成不一定決定泛素化率。通過檢測無細胞裂解物中BD1結構域泛素化初始速率,來了解相同化學系列BiDAC是否在催化效率方面和熱力學參數方面差異。
下圖A中 3個化合物CFT-0251,CFT-0743和CFT-0660在不同濃度下,90min時BD1泛素化免疫印跡條帶。下圖B中用 DMSO或300nM CFT-0251處理樣品,不同時間點的BD1和 BD1_Ub代表性化學發光定量峰圖。通過Digital Western檢測在4個時間點,根據每個時間點獲得的曲線下峰面積AUC測量BD1轉化為泛素化偶聯BD1的量。90分鐘時間內DMSO對照顯示很低背景泛素化水平。相比之下,CFT-0251在300nM濃度時泛素化水平最高,BD1在整個實驗過程中發生明顯的泛素化,進而導致蛋白降解。

降解標簽(dTAG)技術驗證蛋白質降解靶標
常規的靶標確認策略包括RNAi或 CRISPR/Cas9破壞基因表達,從而導致細胞總蛋白水平降低 ,或使用小分子拮抗劑抑制蛋白功能。小分子藥理學方法較單純的基因方法具有許多優勢,包括劑量依賴性效應以及快速且可逆的作用。相比之下,基因方法提供的動態控制較少、無法確定有效劑量且通常完全不可逆。dTAG 靶標確認技術結合了基因和藥理學策略的技術優勢,可快速提供細胞總目的蛋白豐度的劑量依賴性效應,且在降解劑洗脫方面,這種效應是可逆的。靶向蛋白降解劑會敲低整個蛋白質,影響蛋白功能。因此,新的降解劑開發需要評估潛在靶點,靶點驗證是一項重要工作。dTAG降解技術提供了一種可復制推廣的策略,原則上可降解任何細胞內感興趣的蛋白質(POI)。它主要優點是不依賴于蛋白配體或PROTAC的預先存在,具有廣泛地適用性,使其成為蛋白靶標發現和確證的有效策略。

通過CRISPR/Cas9 介導的基因座特異性敲入或慢病毒轉基因表達,靶蛋白表達為一種具有 FKBP12F36V 突變體的嵌合體。dTAG-13等 dTAG 化合物由一個高選擇FKBP12F36V 配體與 E3 連接酶配體連接組成,該配體在融合蛋白和 E3 連接酶之間形成一個三元復合體,從而引起靶蛋白多聚泛素化和降解,dTAG-13 已被用來檢測和驗證癌癥新靶點。
下圖利用dTAG降解劑處理表達FKBP12F36V 融合蛋白,評估探索劑量依賴性降解反應。利用Digital WB檢測蛋白降解水平,最高劑量500nM下觀察到最大降解。在這種情況下,與 5nM dTAG-13 處理相比,用相應的陰性對照 (dTAG-13-NEG) 處理似乎略微降低了目標蛋白水平。A圖CRBN募集dTAG降解劑dTAG-13,B圖是VHL募集的dTAG降解劑dTAGV-1。與 dTAG-13處理一樣,觀察到劑量依賴性降解,最高測試劑量 (500 nM) 下觀察到最大降解。右圖條帶圖和峰面積圖定量數據顯示兩個dTAG降解劑之間的靈敏度差異。與 dTAG-13相比,用dTAGV-1處理后的降解更敏感,在這種情況下,dTAGV-1將用于后續實驗的首選降解劑。
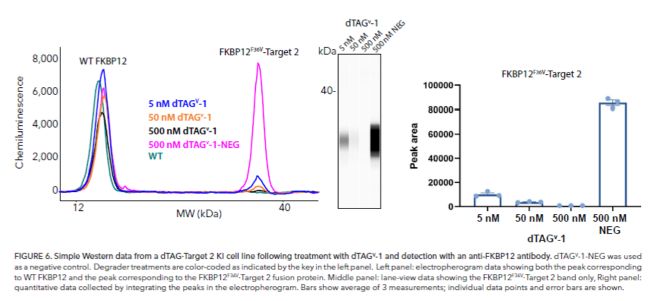
采用dTAGV-1處理野生型FKBP12和FKBP12F36V 靶標2細胞,Digital WB可直接反應融合蛋白與野生型分子量變化,同時準確檢測dTAGV-1劑量依賴性降解反應。
通過以上案例,可知傳統免疫印跡方法重復性較差、定量不準確和操作時間長等技術限制,很難滿足蛋白泛素化水平檢測和靶標驗證的精準定量需求。Digital WB技術是基于毛細管電泳的快速定量免疫學檢測方法,可檢測靶蛋白和泛素化蛋白表達水平,進而準確反應靶向蛋白降解研究過程量效關系和時效關系。Digital WB技術可靈敏地、快速地、可重復性確認內源性蛋白降解,以確保與初步篩選實驗中高通量技術獲得一致性實驗結果,是RPOTAC技術平臺構建的必備技術。已被GSK、Pfizer、Arvinas、Kymera therapeutics、C4 therapeutics,藥明康德和康龍化成等領先RPOTAC藥物研發和服務公司采用。
PROTAC 是 Arvinas, Inc. 的注冊商標,BiDAC是C4 therapeutics的注冊商標。其他商標和注冊商標是其各自所有者的財產,本文引自如下文獻:
1. Jeffrey R. Simard, Linda Lee etc. (2021). High-Throughput Quantitative Assay Technologies for Accelerating the Discovery and Optimization of Targeted Protein Degradation Therapeutics. SLAS Discovery. Vol. 26(4) 503–517
2. Ellen F. Vieux, Roman V. Agafonov etc. (2021). A Method for Determining the Kinetics of Small-Molecule-Induced Ubiquitination. SLAS Discovery. Vol. 26(4) 547–559





