3D 培養的 ATDC5 細胞中機械壓縮應力誘導的 IL-1R 表達
應用于關節軟骨的機械過載可能在骨關節炎 (OA) 的發病機制中起重要作用。然而,對機械過載引起的軟骨退化的病理機制知之甚少。
迄今為止,大量研究報道了 Interleukin-1β(IL-1β)與OA之間存在密切的病理關系。IL-1β 已被證明會引起軟骨細胞中 Ca2+ 水平的瞬時變化,并通過防止調節性容積回縮來影響對低滲透性壓力的反應。此外,之前的一項研究表明,與正常軟骨細胞相比,OA 軟骨細胞中 IL-1 受體 (IL-1R) 的表達水平翻了一番,這表明 OA 軟骨對 IL-1 的敏感性增加。
基于此,日本慶應義塾大學醫學院骨科系、病理學系,日本熊本大學生命科學研究部骨科系的專家學者進行了聯合研究,假設 IL-1 的敏感性和基質降解酶的表達會通過機械壓縮應力和隨后的 ROS 誘導而增加,這可能是由 TRPV4 控制的,TRPV4作為鈣通道機械傳感器,據報道在細胞體積變化的調節中起重要作用。
該研究使用了I型膠原蛋白支架中的 3D 軟骨結構和循環負荷生物反應器,可以應用3D 結構的壓縮變形,模擬人體關節軟骨的體內環境。該研究旨在評估 3D 培養的 ATDC5 細胞中機械壓縮應力誘導的 IL-1R 表達,以及 TRPV4 修飾對 IL-1R 表達的影響。相關研究成果發表在 BMC Musculoskeletal Disorders 題為《Compressive mechanical stress enhances susceptibility to interleukin-1 by increasing interleukin-1 receptor expression in 3D-cultured ATDC5 cells》。
在該研究中,將培養的細胞接種到膠原蛋白支架中,制成 3D 培養的支架。然后在 0.5Hz 下施加 0 kPa、20 kPa 或 40 kPa 的循環壓力加載3h。采用 RT-PCR 分析 40 kPa 循環壓力負荷 3h 后 0、1、3、6、12 h 時培養結構 ADAMTS4、MMP-3 和 IL-1R mRNA 的表達水平。定量測定 0、20、40 kPa 循環壓力加載 3h 后 6h 時 ADAMTS4、MMP-3、IL-6、IL-1β、IL-1R mRNA 表達水平 (圖 1)。
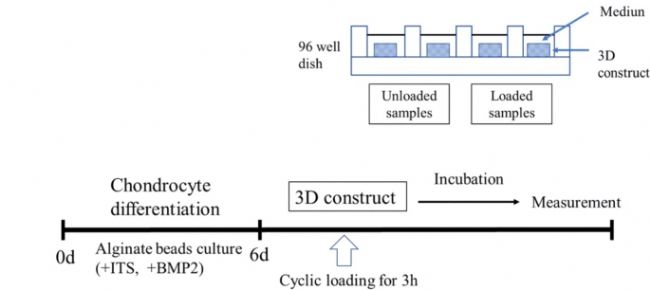
圖 1
實驗結果:
循環壓力負荷對 3D 培養組織的影響
觀察 MMP-3、ADAMTS4、IL-1R mRNA 在 40kpa 循環壓力加載 3h 后表達水平的時間過程 (圖2 a)。
MMP-3 和 ADAMTS4 mRNA 在前 6h 內逐漸增加,12h 后降至對照水平。IL-1R mRNA 表達水平在加載1h 后升高,維持至6h,然后在 12h 后降至對照水平。ADAMTS4、MMP-3、IL-6 和 IL-1R 的 mRNA 表達水平均在 6h 壓力負荷 40kPa 時升高,而在 20kPa 負荷下未觀察到這種 mRNA 表達的增加 (圖2 b)。無論壓力負荷的大小,IL-1β mRNA 的表達沒有變化。
經循環壓力處理的 3D 培養組織表現出 ROS 積累,而無循環壓力處理的細胞則沒有 ROS 積累 (圖3 a)。PDTC是一種抗氧化劑,可顯著防止機械誘導的ADAMTS4和IL-1R的mRNA表達 (圖3 b)。
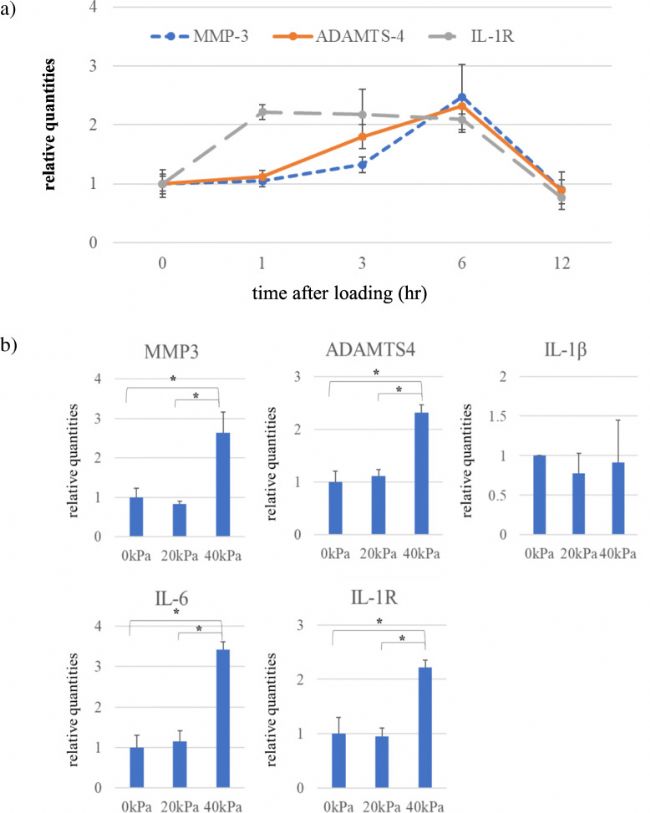
圖 2
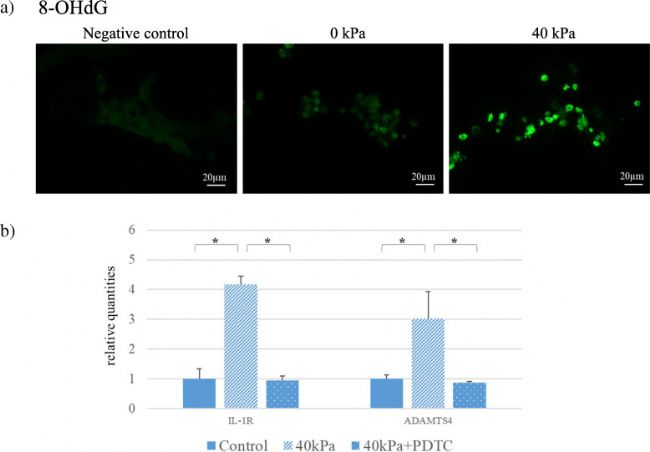
圖 3
通過循環壓力負荷增加 3D 培養組織的 IL-1 敏感性
在沒有壓力負荷的情況下,用足量的 IL-1β (10 ng/ml) 處理 3D 培養組織,觀察到 ADAMTS4 和 IL-1R mRNA 的表達增加 (圖 4)。雖然少量的 IL-1β (1 pg/ml) 單獨不能上調 ADAMTS4 和 IL-1R mRNA 的表達水平,但少量的 IL-1β (1 pg/ml) 與 40-kPa 壓力負荷的結合顯著使ADAMTS4 和 IL-1R mRNA 表達分別增加了 5 倍和 8 倍。
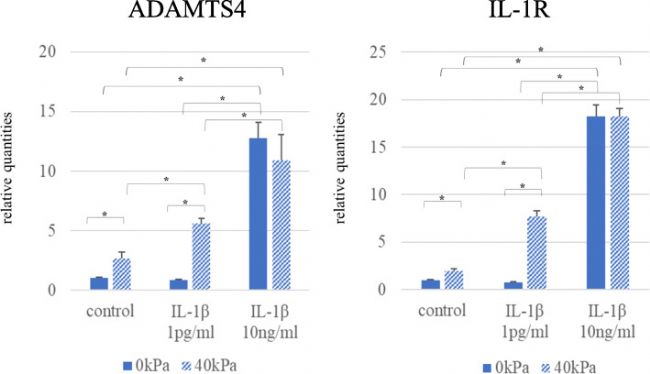
圖 4
TRPV4 通道修飾對 3D 培養組織中ADAMTS4 和 IL-1R mRNA 表達水平的影響
在沒有循環壓力負荷的情況下,TRPV4 激動劑和拮抗劑都不影響 ADAMTS4 和 IL-1R mRNA 的表達水平。然而,TRPV4 激動劑可抑制由 40 kPa 循環壓力負荷誘導的 ADAMTS4 和 IL-1R mRNA 水平的上調。相反,TRPV4 拮抗劑會加速 ADAMTS4 和 IL-1R mRNA 的表達。在 20 kPa 的循環壓力負荷下未觀察到兩種 mRNA 的表達增加 (圖 5)。
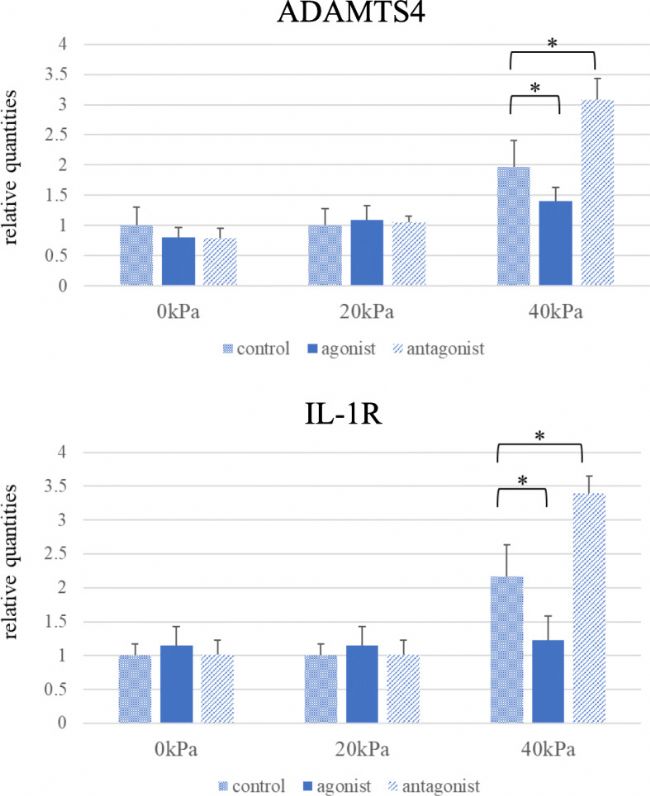
圖 5
TRPV4 和 IL-1R 的免疫反應性隨著循環壓力的增加而增加
與沒有循環壓力加載的結構相比,甲苯胺藍染色的 I 型膠原支架中,3D 培養組織在施加循環壓力后表現出圓形形態 (圖6 a、b)。在3D培養組織中,細胞在0 kPa時延長細胞突起,在40 kPa時細胞突起消失。施加循環壓力對TRPV4 (圖6 d、e) 和IL-1R (圖6 g、h) 的免疫反應顯著增加 (圖6 e、 h),而沒有循環壓力加載則沒有增加 (圖6 d、g)。
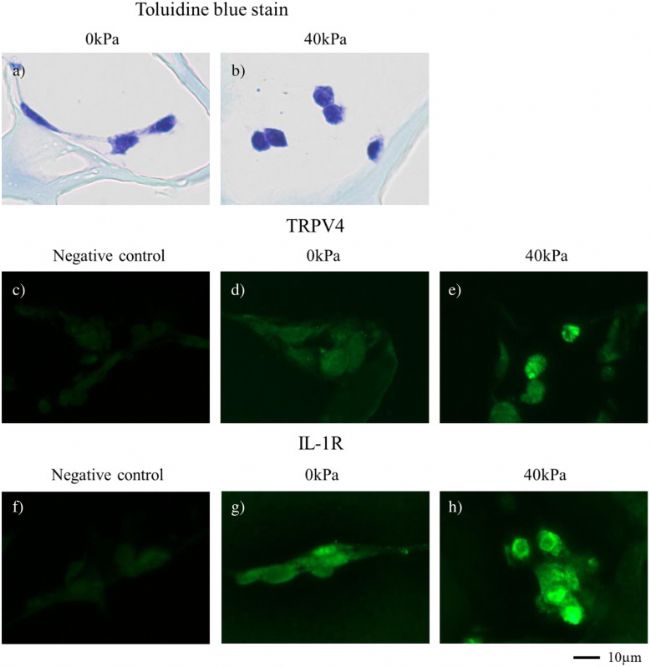
圖 6
實驗結論:
循環壓力負荷通過 ROS 在 3D 培養的 ATDC5 細胞中誘導 ADAMTS4 和 IL-1R 的 mRNA 表達,并且這受 TRPV4 調節。過大的壓力負荷可能會影響 TRPV4 調節。這些發現表明,TRPV4 調節 IL-1R 的表達水平和隨后由循環壓力負荷誘導的 IL-1 信號傳導,并參與軟骨穩態。
參考文獻:Takeda Y, Niki Y, Fukuhara Y, Fukuda Y, Udagawa K, Shimoda M, Kikuchi T, Kobayashi S, Harato K, Miyamoto T, Matsumoto M, Nakamura M. Compressive mechanical stress enhances susceptibility to interleukin-1 by increasing interleukin-1 receptor expression in 3D-cultured ATDC5 cells. BMC Musculoskelet Disord. 2021 Mar 1;22(1):238. doi: 10.1186/s12891-021-04095-x. PMID: 33648469; PMCID: PMC7923672.
文章來源:http://www.naturethink.com/?news/135.html
小編旨在分享、學習、交流生物科學等領域的研究進展。如有侵權或引文不當請聯系小編修正。微信搜索公眾號“Naturethink”,學習更多關于流體機械力學刺激細胞培養相關知識吧!





