腺病毒(AAV)包裝常見問題及解答

病毒載體包裝過程是復雜的,在做病毒包裝實驗中,科研工作者常遇到一些問題。為了讓大家在病毒包裝這塊少走彎路,《細胞基因編輯小課堂欄目》特邀賽業生物細胞生物學產品經理針對病毒包裝常見的問題為大家進行經驗總結與心得分享。有同學留言說想看腺相關病毒(Adeno-associated virus, AAV)包裝,有求必應的小賽這就安排上!
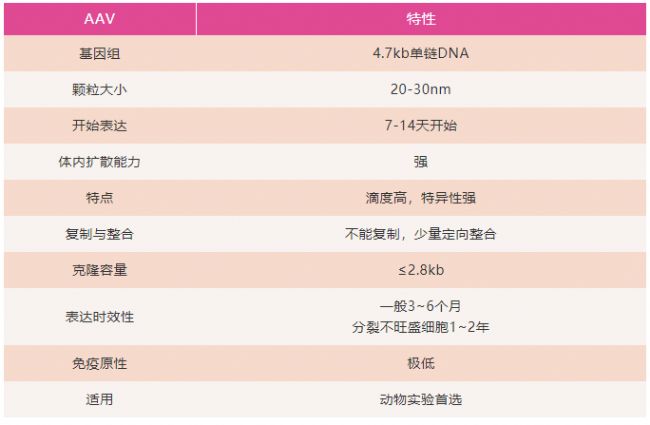
Q1:AAV有哪些特性呢?
Q2:實現AAV在動物體內表達需要注意哪些關鍵點?
1. 血清型的選擇。AAV的血清型主要由AAV衣殼蛋白的結構所決定,不同的衣殼蛋白結構識別不同的細胞表面受體,因此血清型的選擇會影響AAV的感染效率、組織親和性、和開始表達的時間。
2. 啟動子的選擇。是選擇廣譜性啟動子還是特異性啟動子。相比于血清型的組織特異性,特異性啟動子可實現細胞的特異性,因此對特異性要求較高的研究,可以選擇某種細胞特異性表達的啟動子。
3. 注射方式。對于可以進行局部注射的組織器官,采用局部多點注射靶器官可取得較好的特異性和表達效果。
4. 病毒量及滴度。根據不同的靶器官組織和所使用的不同AAV血清型(擴散能力不同),推薦注射的AAV量不同,傳遞到組織中的病毒顆粒數量對于感染效果影響很大。但AAV使用量并不是越多越好,過多的量可能出現病毒溢出,而且根據我們的經驗,病毒量太多有時候甚至會出現表達降低的情況。想了解具體組織的病毒用量可以聯系我們咨詢。
5. 檢測時間。不同基因的表達高峰時間是不同的,再加上AAV需要從單鏈DNA變成雙鏈DNA,一般在2周可檢測到基因表達,如無抗體產生的影響,基因的表達可持續表達半年以上。
Q3:為什么很少用AAV做細胞感染?
主要是因為AAV轉染細胞的表達效率較低,且由于AAV是單鏈DNA,進入細胞后須經歷一個由單鏈變成雙鏈的過程才能進行轉錄翻譯,而在沒有輔助病毒或輔助因子的情況下,這種單鏈DNA復制形成雙鏈DNA的過程十分緩慢,因此存在表達延遲的情況。
另外,體外細胞的生長速率較快,感染至細胞中的AAV會隨著細胞分裂不斷稀釋,進一步導致其表達水平降低。而在體內研究,注射的組織細胞通常不會有那么快的增殖,且各種AAV所攜帶的外源基因表達的因子較為豐富,因此表達豐度和持續的時間更好。
Q4:如何通過AAV實現體內的特異性表達?
由于目的基因在不同組織中功能不同,以及同一組織的不同細胞中功能也可能不同,所以我們實驗過程中經常需要進行特異性表達。AAV可通過以下幾種方式實現體內的特異性表達:
1. 組織特異性血清型。不同血清型的AAV具有不同的組織嗜性,因此首先要選擇對特定組織感染能力強的血清型AAV。
2.(細胞)特異性啟動子。血清型主要利用侵染特異性,而啟動子則是利用表達特異性,如某種特異性啟動子AAV2,可侵染多種組織,但僅在某特定細胞表達。
3. 局部注射。此外還可采用Cre依賴性基因開關(Cre-loxp系統),如用特異性啟動子含cre酶的AAV注射Loxp小鼠實現特定組織或細胞目的基因的敲除。
Q5:AAV作為一種體內常用的工具病毒,可實現什么功能?
1. 基因過表達。將目的基因的CDS區構建到AAV載體,注射到動物體內實現過表達。
2. 基因干擾表達。將針對目的基因設計的shRNA構建到AAV載體,注射到動物體內實現干擾表達。
3. 目的基因的敲除。將針對目的基因設計的gRNA和Cas9編碼序列分別構建到AAV中,注射到動物體內實現基因敲除。
4. 內源過表達。將針對目的基因設計的gRNA和dCas9分別構建到AAV載體,實現內源過表達。
Q6:AAV感染后熒光弱?
熒光弱主要有2方面的原因,一是組織感染的效率較差,另外就是檢測的正確性。對于提高感染效率,則從病毒血清型是否合適、病毒使用量是否夠、滴度是否合適,注射方法是否合理等方面進行分析;而對于檢測,在組織樣本切片制備的過程中,應考慮熒光蛋白的穩定性,如GFP遇酸容易淬滅等因素,從而確保檢測的有效性。
另外,AAV病毒使用前需確認是否出現因儲存不當而導致滴度下降的情況。
Q7:AAV感染后過表達效果弱?
1. 病毒量不夠:應充分調研高分文獻報道,確定AAV滴度及用量,對于找不到參考文獻的,也歡迎咨詢我們。
2. 載體表達效率低:更換啟動子或增加強調控元件。
3. 細胞負反饋機制:少數基因受上下游嚴格調控,這種情況較難實現過表達。
4. 基因序列本身的元件:例如GC含量、隱蔽性剪接位點、轉錄終止信號和核酸二級結構等,也可影響表達。因此,密碼子優化廣泛用于增強AAV中目的基因表達。
Q8:AAV的表達效果能維持多久?
AAV在細胞內主要是以環狀的dsDNA附加體(circularised dsDNA episomes)的形式存在,而不會像慢病毒LV那樣整合到宿主細胞的基因組。對于分裂不旺盛的細胞,如神經元,AAV可持續表達1年以上甚至2年,對于分裂較旺盛的細胞,一般也可維持3~6個月或以上。
Q9:AAV的操作、使用安全性怎么樣?
迄今為止,未發現野生型AAV有致病性,實際上大部分人群都感染過AAV。野生型AAV在無輔助病毒(如腺病毒)的存在下,復制效率非常低。重組腺相關病毒(rAAV)由多個質粒(cis質粒、輔助質粒、rep/Cap質粒)組成,且Cis質粒、輔助質粒與rep/Cap質粒之間不具有同源性序列,因此重組AAV在理論上不具有復制的能力。





