胚胎干細胞(ESC)的鑒定方法與常見問題
干細胞可分為胚胎干細胞(embryonic stem cell, ESC)和成體干細胞(adult stem cell, ASC),其中ESC是來源于囊胚內細胞團的全能干細胞,初次發現于1981年,研究人員從小鼠囊胚中成功分離并實現了體外培養。因ASC是在成年動物體內的組織中分離提取,如骨髓、脂肪和臍帶等,其在體外分化增殖能力有限,僅能分化為特定某幾種類型組織的細胞。
而ESC具有無限的增殖傳代能力及分化全能性,可分化為三個胚層來源的各種組織及細胞類型。這種無可比擬的特性讓ESC成為很多領域的基礎和應用研究的強有力工具,包括發育和調控研究、再生醫學、潛在治療方法。
那么ESC具有什么形態學特征?它有哪些表面標志物?又該如何鑒定其分化潛能呢?請看以下分解。

01 形態學
相對其他細胞,ESC單個細胞個體小,細胞核大,體外培養時呈集落樣或克隆樣生長,克隆內細胞排列緊密,細胞集落有明顯的邊界。此特有的形態學特征常用來做初步鑒定ESC的方法。
例如,Mouse ESC細胞核大,胞核內有多個核仁,核漿比高。在貼壁生長的情況下,Human ESC集落與Mouse ESC不同,呈相對松散、扁平狀集落,集落內細胞界限隱約可見。
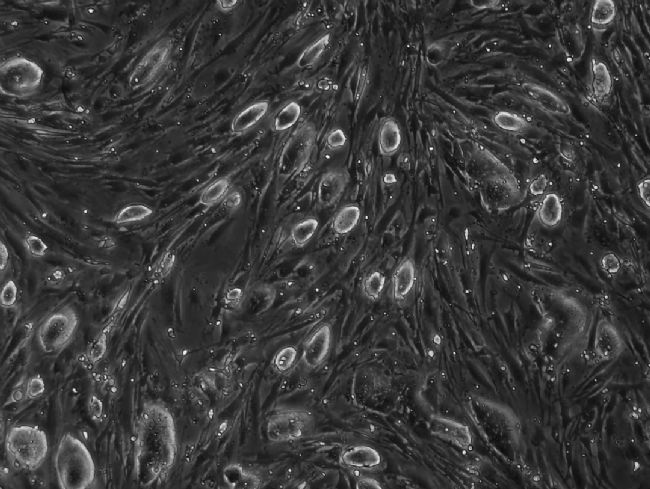
Mouse ESC 40x
02 特異性轉錄因子/抗原表達
ESC鑒定也有獨有的表面標志物,目前常用的檢測標志物是特異性轉錄因子OCT-4、Nanog及階段特異性胚胎表面抗原SSEA。
OCT-4是一個和胚胎發育全能性相關的轉錄因子,幾乎所有的ESC都表達OCT-4,當ESC被誘導向成體細胞分化時,OCT-4的表達逐漸下降。
Nanog是一種有同源結構域的轉錄因子,可以維持ESC的自我更新,以及調節ESC的細胞周期。與OCT-4相似,當ESC分裂旺盛時,Nanog高表達,隨著ESC分化程度的提高而Nanog表達量逐漸下調。
SSEA是一種糖酯蛋白,用來鑒定ESC的SSEA通常有三種,分別是:SSEA-1、SSEA-3、SSEA-4,它的表達具有種屬間特異性。如通過免疫熒光檢測,可發現Human ESC和Mouse ESC具有不同的SSEA表達。
Human ESC的鑒定
- 高表達OCT-4、Nanog、SSEA-3、SSEA-4;
- 低表達SSRA-1。
Mouse ESC的鑒定
- 高表達OCT-4、Nanog、SSEA-1;
- 低表達SSEA-3、SSEA-4。
03 染色體結構
對ESC進行染色體核型分析,方法與成體細胞無異,總體上程序一致。ESC在體外擴增培養后仍維持正常二倍體核型,不隨傳代次數而改變。鏡下觀察Mouse ESC,細胞核型仍然保持正常,核型為40,XX/XY。
04 分化潛能
不同于其他干細胞,ESC具有無限增殖能力,是公認的全能干細胞,在一定條件下具有分化為胚胎的外、中、內三個胚層細胞分化的能力,理論上可以誘導為機體內各種類型的細胞,如可分化為神經干細胞、造血細胞、軟骨細胞、內皮細胞、心肌細胞等。正是由于ESC具有可塑性和無限增殖的特性,使其成為再生醫學和組織工程研究的熱點。
擬胚體(EB)的形成是ESC分化的主要步驟。在缺少小鼠胚胎成纖維細胞(MEF)飼養層的情況下,ESC經EB形成培養基的刺激會自發分化形成三維聚集體,這種結構有利于細胞的相互作用,比如細胞間的接觸和間隙連接的建立。
另外,ESC還能在體內實驗形成畸胎瘤,將其注射至免疫缺陷小鼠觀察是否產生畸胎瘤,若畸胎瘤含有三個胚層來源的細胞,則可說明ESC具有體內分化的潛能。這種畸胎瘤還能維持穩定的二倍體,無惡性病變。
好了,介紹講到這里,是不是都已經明白了呢?還想了解什么內容,可以在評論區和我嘮嘮呀。





