Eppendorf S41i CO2恒溫搖床在間充質干細胞擴增上的應用
作者:Khandaker Siddiquee and Ma Sha, Eppendorf Inc., Enfield, CT, U.S.A
摘要
使用裝載微載體的小型生物反應器如旋轉培養瓶,擴增培養干細胞(包括間充質干細胞)被證明是成功的。而在本研究中我們使用了傳統錐形瓶,為采用微載體進行間充質干細胞擴增開發了一種簡單的替代方法。這種方法需要一臺新型的內置搖床功能的 CO2 培養箱,例如 Eppendorf New BrunswickTM S41i CO2 培養箱。利用裝載微載體的錐形瓶搖瓶和旋轉培養瓶來對比脂肪間充質干細胞(ADMSCs)的擴增效果。兩個對照實驗都使用含有 0.5g 微載體的干細胞培養液 40 mL,ADMSCs 接種密度都為 3×103 個細胞 /cm2。
細胞培養周期為 12 天,每日進行采樣分析細胞生長狀態、生物化學和代謝產物指標進行對比。細胞密度比較結果表明,脂肪間充質干細胞培養在對數生長期(4 天)和平臺期(9 天)中, 在錐形瓶條件下擴增比在旋轉培養瓶條件下細胞數量高 1.6-1.8倍。日常代謝產物分析顯示,培養早期旋轉培養瓶中氨水平較高,但錐形瓶中沒有此現象,這可能是由于攪拌子產生的剪切力造成的干細胞損傷所引起的。
細胞培養周期為 12 天,每日進行采樣分析細胞生長狀態、生物化學和代謝產物指標進行對比。細胞密度比較結果表明,脂肪間充質干細胞培養在對數生長期(4 天)和平臺期(9 天)中, 在錐形瓶條件下擴增比在旋轉培養瓶條件下細胞數量高 1.6-1.8倍。日常代謝產物分析顯示,培養早期旋轉培養瓶中氨水平較高,但錐形瓶中沒有此現象,這可能是由于攪拌子產生的剪切力造成的干細胞損傷所引起的。
最后,通過 CD44 和 CD90 干細胞標記分析,間充質干細胞具有分化成脂肪細胞或骨細胞的能力,這證實了使用錐形瓶擴增的脂肪間充質干細胞具有較高的質量。
綜述
干細胞由于具有自我更新能力并能分裂很長一段時間,從而被視作未分化細胞。當提供合適的生長因子及條件時,干細胞具有分化成不同的特化細胞的能力。干細胞可大致分為:胚胎干細胞、成體干細胞和誘導多功能干細胞(iPS)。成體干細胞可進一步通過它們的組織來源特征性表達,比如:造血干細胞、乳腺干細胞、腸干細胞、間充質干細胞、內皮干細胞、神經干細胞和毛囊干細胞。大部分成體干細胞研究使用的是造血干細胞或者脂肪來源的間充質干細胞 1。像其他的成體干細胞一樣, 脂肪間充質干細胞(AdMSCs)可顯示所有干細胞常規標志物, 并能在合適的生長條件下分化成不同類型的特化細胞。與其他間充質干細胞相比,脂肪間充質干細胞由于可從脂肪組織中大量分離并對凋亡耐受所以更具優勢 2。
盡管間充質干細胞在藥物更新、藥物篩選以及藥物研發中具有諸多優勢,但其應用受到工業或臨床運用所需數量的限制 3。在本研究中,我們開發了一種簡單的錐形瓶培養技術來擴增基于微載體的間充質干細胞培養,從而可將培養規模放大至更大的生物反應器。裝載微載體的錐形瓶需同時控制攪拌速度和 CO2 濃度,我們可利用 Eppendorf New BrunswickTM S41i CO2 恒溫搖床進行培養實驗。

Eppendorf New BrunswickTM S41i CO2 恒溫搖床,為懸浮細胞及貼壁細胞的培養而設計,配備可靠的 New Brunswick 搖床驅動軸,并可精確控制溫度和CO2 濃度。先進特性包括帶密封圈的內 / 外門、高溫消毒功能以及與同類產品相比 CO2 氣體消耗量較少 4。
材料和方法
在細胞培養瓶中進行的最初培養
脂肪來源的間充質干細胞來源于 ATCC(PCS-500-011)第二代細胞,以 5000 個細胞 /cm2 接種于 Eppendorf T-75 cm2 細胞培養瓶中,使用 15 mL 添加有 2% 胎牛血清、5 ng/mL 重組人堿性成纖維細胞生長因子、5 ng/mL 重組人酸性成纖維細胞生長因子、5 ng/mL 重組人上表皮生長因子和 2.4 mM L- 丙氨酰 - L 谷氨酰胺的間充質干細胞基礎培養基(ATCC)。
在實驗開始之前, 將 0.5g 125-212 微米聚苯乙烯微載體(SoloHill®)(180 cm2 適用于 50 mL 的培養)轉移到經過硅化處理((Sigmacoat®,Sigma) 的250 mL 旋轉培養瓶(Corning®) 以及含有 25-30 mL PBS 的錐形瓶中(Schott®, Duran)。隨后,所有培養瓶在 121 °C 下至少高溫滅菌 30 分鐘。微載體可放置在培養瓶或錐形瓶的底部,使用裝有 25 mL 或 50 mL 移液管的 Easypet®(Eppendorf)電動助吸器小心注入經高溫滅菌的 PBS 緩沖液。脂肪來源的間充質干細胞最初以 3000 個細胞 /cm2 的密度接種于兩種培養瓶中,每個均裝載 40 mL 間充質干細胞基礎培養基。
為了培養初期的細胞貼壁,Eppendorf New BrunswickTM S41i CO2 恒溫搖床以及旋轉培養瓶( 安置于 Eppendorf Galaxy® 170 R CO2 培養箱內部)的攪拌轉速皆維持在 50 rpm,在 37 °C、5%CO2 濃度條件下培養 2 小時。之后,細胞培養體積最終被調節至 50 mL,其中 10 mL 的培養基中含有血清,從而使得最終的胎牛血清濃度達到 4%,并使生長添加物的最終濃度達到目標(重組人堿性成纖維細胞生長因子、重組人堿性成纖維細胞生長因子和重組人上表皮生長因子的最終濃度達 10 ng/ml、L- 丙氨酰 -L 谷氨酰胺的最終濃度達 4.8 mM)。在添加 FBS 和生長添加物之后,旋轉培養瓶和 New BrunswickTM S41i CO2 恒溫搖床攪拌轉速都增至 70 rpm。接種 18 小時至24 小時之后,取 1 mL 包含有培養基和微載體的均勻樣品用于顯微鏡觀察、細胞計數和生化分析。
細胞計數
通過血球計數板計算微載體上的細胞。為了完成計數,從試管中移取上清液與含結晶紫的檸檬酸溶液(0.1 M 檸檬酸溶液中添加 0.1 % 結晶紫)等體積混合。試管中的內容物在 37 °C下培養 1 個小時或過夜,渦旋幾秒鐘以釋放被染色的細胞核。使用血球計數板對細胞核計數。
生化以及代謝分析
細胞計數收集的上清液被用于生化以及代謝測量,使用 YSI 2950 自動生化分析儀。
干細胞表面標記物分析
為評估脂肪來源間充質干細胞擴增后的質量,并確保微載體培養期間保留了干細胞的標志物,CD44 和 CD90 的特定熒光免疫分析通過如下步驟進行。在使用微載體的培養末期,分別從轉瓶和錐形瓶中取出 5 mL 樣品。當微載體沉淀于底部上清液被移除后,在室溫條件下使用 PBS 潤洗負載有細胞的微載體三次,隨后在多聚甲醛中固定 30 分鐘,再用 PBS 潤洗三次。在室溫下,將包含有細胞的微載體在 5% PBS 中浸泡 1 小時, 使用FITC - 連結抗人CD44 抗體(Biolegend)和APC 連結抗人 CD90(Biolegend)抗體溶液免疫染色樣品,在室溫條件下維持 1 小時。隨后,在室溫條件下使用 PBS 潤洗包含有細胞的微載體五次,并且使用 EVOS FL 熒光顯微鏡觀察。
生化以及代謝分析
細胞計數收集的上清液被用于生化以及代謝測量,使用 YSI 2950 自動生化分析儀。
干細胞表面標記物分析
為評估脂肪來源間充質干細胞擴增后的質量,并確保微載體培養期間保留了干細胞的標志物,CD44 和 CD90 的特定熒光免疫分析通過如下步驟進行。在使用微載體的培養末期,分別從轉瓶和錐形瓶中取出 5 mL 樣品。當微載體沉淀于底部上清液被移除后,在室溫條件下使用 PBS 潤洗負載有細胞的微載體三次,隨后在多聚甲醛中固定 30 分鐘,再用 PBS 潤洗三次。在室溫下,將包含有細胞的微載體在 5% PBS 中浸泡 1 小時, 使用FITC - 連結抗人CD44 抗體(Biolegend)和APC 連結抗人 CD90(Biolegend)抗體溶液免疫染色樣品,在室溫條件下維持 1 小時。隨后,在室溫條件下使用 PBS 潤洗包含有細胞的微載體五次,并且使用 EVOS FL 熒光顯微鏡觀察。
干細胞分化分析
從錐形瓶和轉瓶中收獲脂肪間充質干細胞,并置于 50 mL 試管中。當微載體沉淀于試管底部之后, 移除上清液, 使用DPBS 清洗細胞。隨后,在 37 °C 下使用 5 mL 預熱過的胰蛋白酶 - EDTA 溶液處理 10 分鐘。在培養期間,隨機渦旋試管2 秒鐘,并加入等體積的胰蛋白酶中和溶液。微載體沉淀于試管底部,隨即收集上清液。使用 DPBS 清洗微載體 2-3 次,并收集盡量多的上清液于 50 mL 試管中。潤洗之后 120 g 離心5 分鐘,脂肪間充質干細胞被收集于試管底部,并在 5 mL 間充質干細胞培養基中重懸。以 18000 個細胞 /cm2 的密度接種于 24 孔板中。使用 ATCC 分化分析試劑盒分析脂肪細胞和骨細胞的分化情況。分化的脂肪細胞和骨細胞可以依據 Oil red O 或者Alizarin red S 試劑盒(ScienCell®)廠商的指示將特定細胞染色來鑒別。使用 OLYMPUS CK40 顯微鏡觀察。
結果與討論
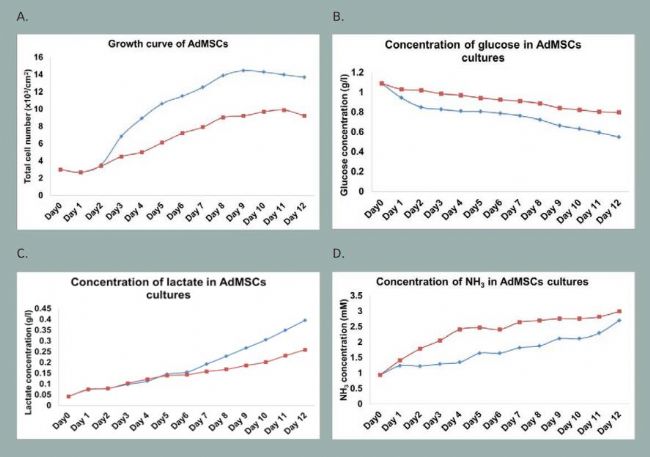
為了比較錐形瓶和轉瓶培養,在兩種培養體系中脂肪來源的間充質干細胞以 3000 個細胞 /cm2 接種。細胞培養比較持續了12 天,每天取樣分析細胞生長、生化以及代謝情況。通過細胞生長對比發現,使用錐形瓶培養脂肪間充質干細胞,其細胞密度在對數生長早期(第 4 天)以及平臺期(第 9 天)是轉瓶培養的 1.6 到 1.8 倍(圖 1 A)。生化以及代謝分析揭示在搖瓶中培養細胞時葡萄糖含量從 1.09 g/L 降至 0.548 g/L,在轉瓶中培養時葡萄糖含量則降至 0.798 g/L。而在培養 12 天之后,錐形瓶中的乳酸含量從 0.042 g/L 升高至 0.396 g/L,在轉瓶
中則升高至 0.259 g/L(圖 1B 和 1C)。錐形瓶中較高的葡萄糖消耗速率以及乳酸生成速率表明在錐形瓶條件下干細胞生長更快。此外,在生長早期(第 4 天)轉瓶中的氨累積濃度(2.4 mM)是錐形瓶培養(1.3 mM)的 1.8 倍(圖 1D)。文獻證實即使是低濃度的氨(1.9 mM)也會抑制間充質干細胞的生長 5。轉瓶培養顯示在培養初期及隨后的培養過程中氨的濃度已經超過了 2 mM,表明轉瓶培養中較慢的細胞生長速率可能由氨累積誘導的毒害作用所引起。在培養初期轉瓶培養中氨的累積與錐形瓶相比有所增加表明了由攪拌子引起的剪切力可能對干細胞產生傷害。攪拌子在低速時有“停頓和啟動”的動作,在低攪拌速度的條件下,精確的轉速控制是不可能的。
為了判定脂肪來源的間充質干細胞在錐形瓶培養過程中是否保持干細胞特性,我們分析了干細胞表面標記物的免疫染色以及分化,使用干細胞表面標記抗體,如 FITC- 連結抗人 CD44 抗體和 APC 連結抗人 CD90 抗體對包含有脂肪來源間充質干細胞的微載體進行免疫染色,并且表明了脂肪來源的間充質干細胞在錐形瓶培養過程中保持了干細胞特性(圖 2A 和 B)。對于脂肪細胞和骨細胞的分化分析,脂肪來源的間充質干細胞從微載體上收集并接種于包含有脂肪細胞或骨細胞分化培養基的 24 孔板中。培養 17 天之后,使用Oil red O 或者Alizarin red S 染色溶液進行染色。顯微鏡觀察表明搖瓶培養中大部分的脂肪來源間充質干細胞成功分化成脂肪細胞或者骨細胞(圖 3A 和B)。

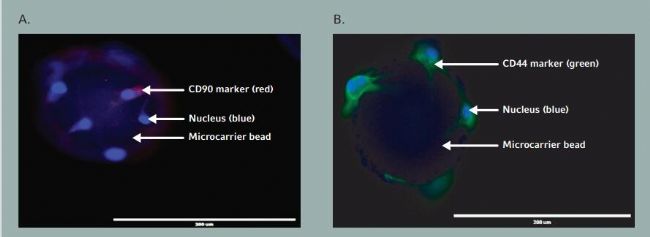
- 微載體上脂肪間充質干細胞對 CD90 干細胞標記物顯示陽性,在熒光成像下顯示紅色
- 微載體上脂肪間充質干細胞對 CD44 干細胞標記物顯示陽性,在熒光成像下顯示綠色。藍色表示由 DAPI 染色的干細胞核。
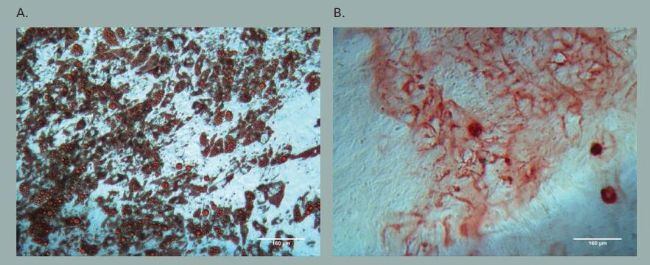
A) 由 Oil red O 陽性染色表明脂肪細胞分化形成了脂質小滴
B) 由 Alizarin red S 陽性染色顯示骨細胞分化引起了細胞外基質的鈣結合
結論
與旋轉培養瓶培養體系相比,使用錐形瓶培養擴增間充質干細胞成為一種可行以及簡單的替代方法。這種新方法依賴于一種新型的內置搖床功能的二氧化碳培養箱,例如 New BrunswickTM S41i CO2 恒溫搖床。New BrunswickTM S41i CO2 恒溫搖床降低了剪切力,減少了攪拌子對細胞所產生的潛在危害,緩解了在CO2 培養箱中裝載旋轉培養儀帶來污染的風險并降低了實驗的復雜性。由于在 New BrunswickTM S41i CO2 恒溫搖床中可以放置大量的錐形瓶,這同樣極大增加了培養細胞的能力。在轉瓶培養的案例中,傳統的、沒有主動冷卻功能的培養箱只能應付少量旋轉培養儀發出的熱量,容易導致溫度過高這也顯著限制了使用轉瓶擴增細胞的應用。與之相比,使用New BrunswickTM S41i CO2 恒溫搖床培養干細胞更具有優勢,該方法減少了細胞擴增時遇到的瓶頸, 并為大規模用于生產臨床材料的工業生物反應器接種提供了高質量的干細胞。
標簽:
恒溫搖床 間充質干細胞擴增
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





