美國計量院研討會關于細胞治療產品活率測量技術開發探討重點匯總
引言
繼2017年美國國家標準與技術研究院(NIST, 簡稱美國國家計量院) 和食品與藥物管理局(FDA)舉辦了一場專注于細胞計數的研討會后,2020年12月15日,NIST和Nexcelom Bioscience聯合舉辦了一場關于細胞活率的研討會。超過40位細胞治療行業的相關人員參加了此次研討會,共同探討了當前細胞治療產品活率測量領域面臨的挑戰。會議討論結果發表在了Cell & Gene Therapy Insights. 以下正文是文獻的全篇翻譯。
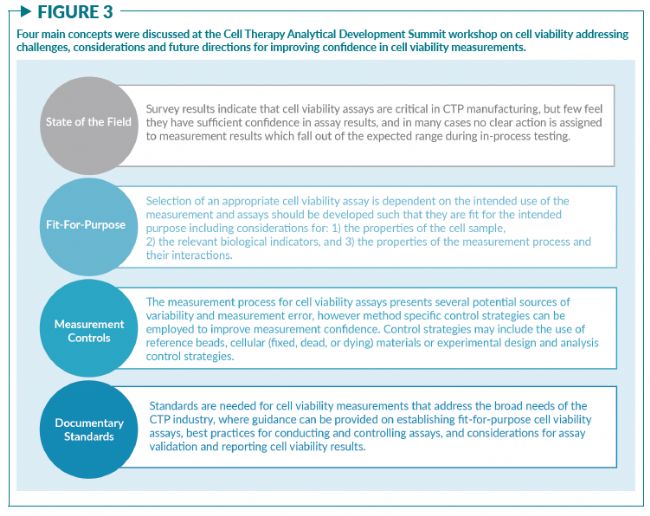
- 與會者一致認同細胞活率測量方法的開發必須遵循fit-for-purpose (量體裁衣)的原則,選擇符合既定目的與既定用途(比如細胞計數傳代,細胞殺傷實驗和確定CTP的劑量和純度)的方法。
- 一個fit-for-purpose的活率測量方法必需綜合考慮生物學指標的選擇(細胞膜通透性、代謝水平、分子標志物等),細胞樣本的屬性(紅細胞殘留、聚集程度等),和方法的性能標準(準確度、精密度、耐用性等)。
- 測量方法的選擇會影響細胞活率的結果,比如1)由于樣本中存在紅細胞殘留,明場成像和臺盼藍染色將對原代細胞樣本的活率測量產生顯著影響;2)臺盼藍染料和染色時間會影響死亡和瀕死的免疫細胞群;3)基于液流系統的機械應力會在測量過程中改變細胞活率。
- 通過實施控制策略可以提高活率測量的置信度。NIST演示了針對三種基于圖像原理的測量方法的控制策略,用以監控和應對由測量過程中特定節點引起的潛在變化。
- 對照材料,如商品化的參考微珠和實驗室制備的固定死細胞樣本,可用于建立細胞活率測量中的控制策略。不過目前還尚未有任何一類參考物質被認證可充分代表各種類型的細胞樣本。對照材料的屬性范圍應該與待測細胞樣本的屬性范圍一致。
- 細胞活率的結果報告應包含測量使用的方法和所測生物指標的信息。例如,當報告一個細胞樣本的活率為70%時,需附加更具體的信息(比如用基于成像分析原理的AO/PI染色法測得)。
- 細胞活率測量的通用標準尚在開發中。一套支持選擇、開發和驗證fit-for-purpose的細胞活率測量方法的標準將有助于加速細胞治療產品的開發。
介紹
細胞活率是細胞治療產品(即以細胞作為活性物質的產品,比如CAR-T細胞療法)生產和放行的基本測量指標之一。評估細胞治療產品 (CTP) 中活細胞、死細胞或瀕死細胞的存在至關重要。死細胞、瀕死細胞和細胞碎片可能會引發不必要的免疫反應;活細胞太少則可能會降低產品的有效性。活率檢測也可以作為確定CTP的強度或劑量(即活細胞濃度)的方法,并作為細胞毒性檢測的一部分,用來評估CAR-T的效力。除了在產品表征和放行檢測中需要評估細胞活率外,活率的測量也可以作為過程控制的指標之一,為整個生產過程的決策提供關鍵信息(圖1)。
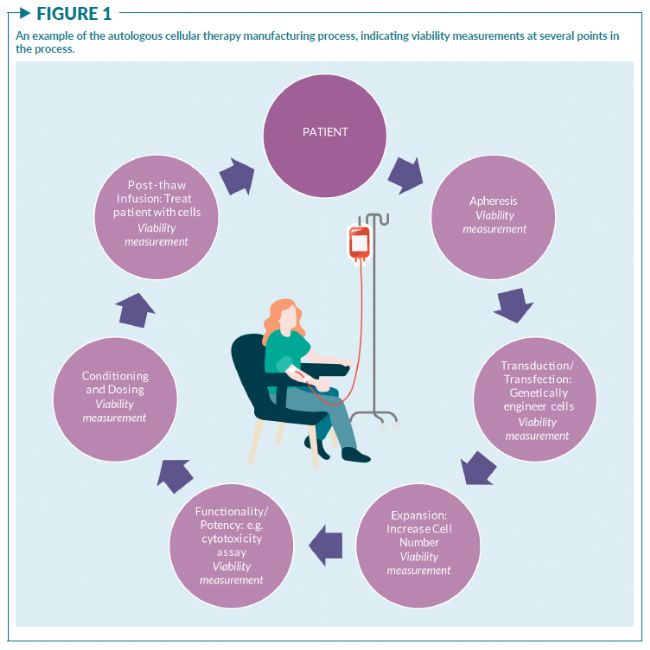
活細胞和死細胞的定義通常被認為是對細胞健康連續動態變化的瞬時解讀。由于現有的細胞活率測量原理、方法和檢測儀器多種多樣,以及評估細胞活率的目的各不相同(圖2),細胞治療行業亟需更為嚴格的方法來選擇、設計和控制細胞活率測量。

2020年12月15日,美國國家標準與技術研究院 (NIST,簡稱美國國家計量院)和Nexcelom Bioscience在“細胞療法分析開發峰會”上聯合舉辦了一場關于細胞活率的研討會,包含了三場主題演講:“細胞活率測量:我們真正測量的是什么?”“你選擇的測量方法如何影響活率結果?” 以及“實驗案例和測量控制” 。每一個環節都探討了在細胞治療行業中細胞活率測量遇到的共同挑戰,并討論了如何以“fit-for-purpose”(量體裁衣)的方式選擇細胞活率的測量方法。超過40位來自于生物技術企業、制藥公司、設備供應商、科研實驗室和政府實驗室的相關人員加了此次研討會,討論了如圖3所示的四個主要議題。
問卷調查結果
二十四位與會者參與了一項問卷調查,詢問在進行細胞活率測量時遇到的共同問題和挑戰。問卷結果顯示最常見的問題是不確定測量方法的準確性,其次是不了解測量結果與產品效力的相關性。整個行業遇到的一個共同挑戰是測量方法的選擇。79%的參與者表示,他們在選擇細胞活率測量方法時最重要的考慮因素是測量的質量,即通過準確性、精密度、特異性和可重復性等指標來衡量。在細胞活率測量所基于的生物指標方面,最常用的測量方法是熒光細胞核染色法(83%受訪者)。
基于fit-for-purpose 原則的方法開發
在整個研討會中,與會者都強調了以fit-for-purpose (量體裁衣,符合既定目的與既定用途)為原則開發細胞活率測量方法的必要性。基于活率測量的預期目的(例如在CTP生產過程中,初始單采分離物的表征,在擴增過程中監測細胞,或用于產品放行等),可以通過三方面的考量來選擇fit-for-purpose的方法:
- 1) 選擇合適的生物學指標;
- 2) 考慮細胞樣本的屬性;
- 3) 考慮測量方法的性能標準(圖4)
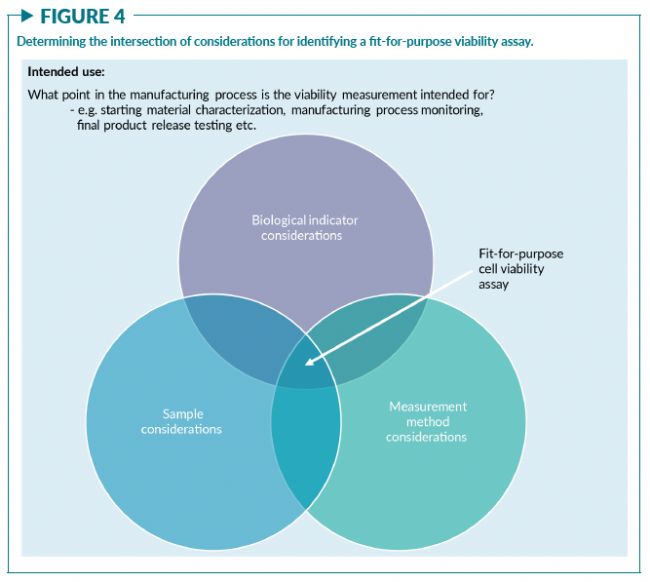
這三個方面的相互作用將主導測量系統的構建。研討會上關于樣品屬性和測量方法之間相互作用的例子在“選擇的測量方法會影響活率結果”一節中給出。
圖1顯示了一個典型的CTP生產流程,標注了需要細胞活率測量的幾個環節。評估細胞活率的分析方法可能因所處不同步驟而不同。例如,在CAR-T生產過程中,新鮮分離或冷凍保存的PBMC樣本中可能存在RBC殘留或碎片。在這種情況下,細胞活率和計數方法必須僅計數有核細胞,避免對紅細胞、血小板和碎片的非特異性計數。而在生產流程的下游環節,比如在細胞擴增或放行前的效力檢測時,樣本會更純凈。針對這些樣本選擇的活率測量方法可能會與在生產早期測量PBMC的方法不同。
細胞活率測量的另一個預期用途是體外細胞毒性檢測。在進行檢測之前,需要對效應細胞和腫瘤靶細胞進行準確的細胞數量和活率測量,來正確評估效應細胞的殺傷能力。細胞活率測量的誤差可能會錯誤地評估效應細胞的特異性殺傷功能。在這種情況下,效應細胞和靶細胞的活率測量可能會因這些細胞的不同屬性(即濃度、形態、穩定性等)而不同。
在討論期間,細胞樣本的屬性也是建立fit-for-purpose活率測量方法的一個重要考慮因素。樣本可以有各種各樣的屬性,包括不同水平的碎片、污染細胞系、形態特征、聚集性和脆弱度。在確定適合的測量方法時,通常要考慮樣品的基本性質,如濃度范圍、細胞類型和懸浮溶液。進一步的考慮包括細胞的狀態,樣品中可能存在的受污染的細胞或碎片,以及在活率測量期間細胞樣本的穩定性。細胞的狀態可能受到在活率分析之前經過的處理的影響。例如,冷凍后直接解凍的細胞測得的活率可能與新鮮制備的細胞不同。細胞活率評估的時間也可能影響活率測量的結果,比如當細胞從凍存中復蘇或持續培養中恢復時,其屬性可能發生改變。此外,也需要考慮樣本是否有足夠的量用于測量。如果樣本量有限,一個fit-for-purpose的方法需要體積盡可能小的樣品量進行分析。其他需要考慮的實際因素還包括每次分析的成本、通量、自動化需求或培訓需求,以及法規或其他方面。
當開發一個合適的活率測量方法時,樣品在分析期間的穩定性也應該是一個重要的考慮因素。活率測量通常是一個瞬時行為,為活和死的連續過程捕獲離散的信息。細胞樣本的活率可能隨時間或樣品制備過程而改變,死細胞和污染碎片可能會增加,或在測量過程中由于細胞粘附到離心管壁或移液管而導致細胞丟失。例如,在流式細胞術染色過程中進行的樣品清洗步驟可能會去除部分失活細胞群而影響活率測量。細胞樣本中污染細胞或碎片的存在是建立活率測量方法的另一重要考慮因素,方法對目標細胞群的特異性識別至關重要。
關于細胞樣本的另一個考慮因素是樣本間的異質性。當用于分析的樣本之間差別很大時,比如樣本來自于患有不同程度疾病的捐獻者,一個fit-for-purpose的方法必須可接納這種差異性,且必須用同等程度差異性的樣本對方法進行驗證。
開發細胞活率測量方法除了需要考慮樣本屬性和生物指標,還需考慮方法的性能標準(如準確度、精密度、靈敏度、線性和耐用性)。確保測量置信度的控制策略也應納入fit-for-purpose的細胞活率測量方法中。NIST在研討會上介紹了幾種控制策略,并在“通過控制策略提高活率測量的置信度”一節中進行了描述。
與會者一致認為需要選擇“fit-for-purpose”的細胞活率測量方法以滿足預期目的,包括細胞計數傳代,細胞殺傷實驗和確定CTP的劑量和純度。圖4表明,細胞活率測量方法的開發最好可以兼顧細胞樣本屬性、測量方法和生物指標三方面的考量,以支持其預期的用途。
圖1顯示了一個典型的CTP生產流程,標注了需要細胞活率測量的幾個環節。評估細胞活率的分析方法可能因所處不同步驟而不同。例如,在CAR-T生產過程中,新鮮分離或冷凍保存的PBMC樣本中可能存在RBC殘留或碎片。在這種情況下,細胞活率和計數方法必須僅計數有核細胞,避免對紅細胞、血小板和碎片的非特異性計數。而在生產流程的下游環節,比如在細胞擴增或放行前的效力檢測時,樣本會更純凈。針對這些樣本選擇的活率測量方法可能會與在生產早期測量PBMC的方法不同。
細胞活率測量的另一個預期用途是體外細胞毒性檢測。在進行檢測之前,需要對效應細胞和腫瘤靶細胞進行準確的細胞數量和活率測量,來正確評估效應細胞的殺傷能力。細胞活率測量的誤差可能會錯誤地評估效應細胞的特異性殺傷功能。在這種情況下,效應細胞和靶細胞的活率測量可能會因這些細胞的不同屬性(即濃度、形態、穩定性等)而不同。
在討論期間,細胞樣本的屬性也是建立fit-for-purpose活率測量方法的一個重要考慮因素。樣本可以有各種各樣的屬性,包括不同水平的碎片、污染細胞系、形態特征、聚集性和脆弱度。在確定適合的測量方法時,通常要考慮樣品的基本性質,如濃度范圍、細胞類型和懸浮溶液。進一步的考慮包括細胞的狀態,樣品中可能存在的受污染的細胞或碎片,以及在活率測量期間細胞樣本的穩定性。細胞的狀態可能受到在活率分析之前經過的處理的影響。例如,冷凍后直接解凍的細胞測得的活率可能與新鮮制備的細胞不同。細胞活率評估的時間也可能影響活率測量的結果,比如當細胞從凍存中復蘇或持續培養中恢復時,其屬性可能發生改變。此外,也需要考慮樣本是否有足夠的量用于測量。如果樣本量有限,一個fit-for-purpose的方法需要體積盡可能小的樣品量進行分析。其他需要考慮的實際因素還包括每次分析的成本、通量、自動化需求或培訓需求,以及法規或其他方面。
當開發一個合適的活率測量方法時,樣品在分析期間的穩定性也應該是一個重要的考慮因素。活率測量通常是一個瞬時行為,為活和死的連續過程捕獲離散的信息。細胞樣本的活率可能隨時間或樣品制備過程而改變,死細胞和污染碎片可能會增加,或在測量過程中由于細胞粘附到離心管壁或移液管而導致細胞丟失。例如,在流式細胞術染色過程中進行的樣品清洗步驟可能會去除部分失活細胞群而影響活率測量。細胞樣本中污染細胞或碎片的存在是建立活率測量方法的另一重要考慮因素,方法對目標細胞群的特異性識別至關重要。
關于細胞樣本的另一個考慮因素是樣本間的異質性。當用于分析的樣本之間差別很大時,比如樣本來自于患有不同程度疾病的捐獻者,一個fit-for-purpose的方法必須可接納這種差異性,且必須用同等程度差異性的樣本對方法進行驗證。
開發細胞活率測量方法除了需要考慮樣本屬性和生物指標,還需考慮方法的性能標準(如準確度、精密度、靈敏度、線性和耐用性)。確保測量置信度的控制策略也應納入fit-for-purpose的細胞活率測量方法中。NIST在研討會上介紹了幾種控制策略,并在“通過控制策略提高活率測量的置信度”一節中進行了描述。
與會者一致認為需要選擇“fit-for-purpose”的細胞活率測量方法以滿足預期目的,包括細胞計數傳代,細胞殺傷實驗和確定CTP的劑量和純度。圖4表明,細胞活率測量方法的開發最好可以兼顧細胞樣本屬性、測量方法和生物指標三方面的考量,以支持其預期的用途。
測量方法的選擇會影響細胞活率的結果
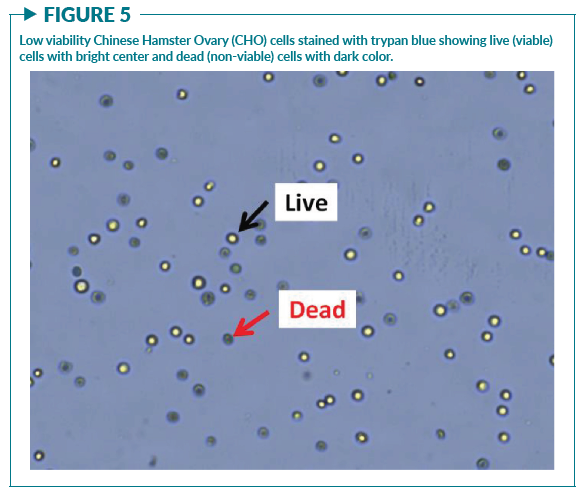
測量方法本身會影響樣本,從而影響細胞活率的檢測結果。確定細胞活率的方法有多種,有的可以直接計算出樣本中總細胞、活細胞和死細胞的數量。這種情況下細胞活率并不是一個測量值,而是通過計算活細胞數占總細胞數的比例獲得。例如,臺盼藍染色法會分別計數活細胞(明亮的中心)和死細胞(深藍色)(圖5),再計算活率,使用公式為
因此,如果細胞計數結果由于測量方法而受到干擾,則活率結果也會受到顯著影響。研討會討論了細胞計數方法對細胞活率結果的三種影響。第一,由于樣本中存在紅細胞(RBC)殘留,明場成像和臺盼藍染色將對原代細胞樣本的活率測量產生顯著影響;第二,臺盼藍染料和染色時間會影響死亡和瀕死的免疫細胞群;第三,基于液流系統的機械應力會在測量過程中改變細胞活率。
原代細胞通常是CTP的關鍵組成部分。測量單采血樣本或PBMC等原代細胞時的主要問題之一是殘留紅細胞的存在。使用明場成像和臺盼藍染色直接對這些原代細胞樣品進行計數可能會誤將殘留的紅細胞也計數在內。由于紅細胞在明場成像中也會顯示為具有明亮中心的圓形物體,因此活細胞計數或細胞濃度可能會被高估,從而使計算出來的細胞活率百分比增加(圖6A)。在Chan等人先前發表的文章中,發現樣本中殘留的紅細胞濃度是有供體差異的,因此在計算活率時會產生很強的可變性(圖6B)。為了提高原代細胞樣本中活細胞計數的準確性,可以利用熒光核染色排除殘留紅細胞、血小板和細胞碎片的計數(圖7)。熒光細胞核染料,如吖啶橙(AO)和碘化丙啶(PI)可以提高對活細胞和死細胞判斷的準確性,從而提高活率計算的一致性 。
原代細胞通常是CTP的關鍵組成部分。測量單采血樣本或PBMC等原代細胞時的主要問題之一是殘留紅細胞的存在。使用明場成像和臺盼藍染色直接對這些原代細胞樣品進行計數可能會誤將殘留的紅細胞也計數在內。由于紅細胞在明場成像中也會顯示為具有明亮中心的圓形物體,因此活細胞計數或細胞濃度可能會被高估,從而使計算出來的細胞活率百分比增加(圖6A)。在Chan等人先前發表的文章中,發現樣本中殘留的紅細胞濃度是有供體差異的,因此在計算活率時會產生很強的可變性(圖6B)。為了提高原代細胞樣本中活細胞計數的準確性,可以利用熒光核染色排除殘留紅細胞、血小板和細胞碎片的計數(圖7)。熒光細胞核染料,如吖啶橙(AO)和碘化丙啶(PI)可以提高對活細胞和死細胞判斷的準確性,從而提高活率計算的一致性 。


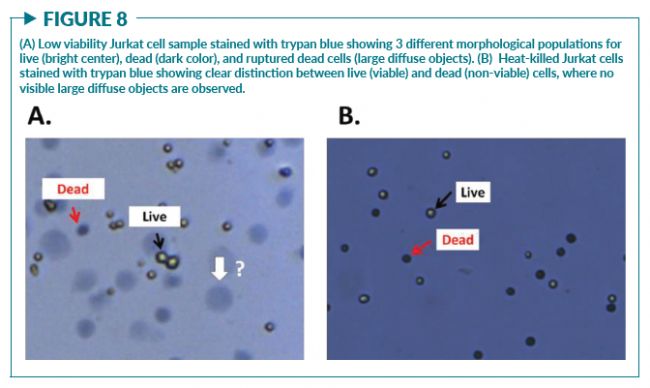
影響細胞活率計算的另一個因素是染料本身,特別是傳統方法常使用的臺盼藍。在Chan等人的研究中發現,在用臺盼藍對低活率的Jurkat細胞和小鼠脾細胞進行染色后,觀察到三個形態學上不同的群體:活細胞(明亮的中心),死細胞(深藍色)和未知(大的彌散物體)(圖8A)。后續的定量實驗證明當細胞被臺盼藍染色時,死細胞的密度降低了。結果顯示,AO/PI染色和臺盼藍染色測得的活細胞濃度是一致的;但是,臺盼藍測得的死細胞濃度要低得多。有趣的是,對熱殺傷的Jurkat細胞樣本染色時,未觀察到較大的彌散物體(圖8B)。在發現了這些彌散物體的存在之后,研究者進行了一項實驗以確定彌散物體的起因和構成。在先前獲得的視頻中,發現這些彌散物體直接來源于與臺盼藍相互作用的死亡或瀕死的免疫細胞(PBMC),證明有可能是染料的滲透作用裂解了細胞。該現象會使死細胞的數量被低估,從而高估細胞活率。實驗證實PI不會引起與臺盼藍類似的細胞形態變化 。
前面兩個例子表明由于活細胞計數和死細胞計數誤差的影響而導致細胞活率計算存在可變性。還有其他因素可以直接影響實際的細胞活率,例如染料誘導的細胞毒性和機械應力誘導的細胞活率降低。Mascotti等人的研究(2000)表明,臺盼藍在大約十分鐘后可誘導細胞死亡,導致細胞活率降低,而AO/PI染色方法顯示了長達120分鐘的活率穩定性。歐洲藥典標準(2.7.29)關于 “有核細胞計數和活率” 的部分提示了在臺盼藍染色溶液中細胞孵育時間的重要性,并指出在數據采集之前,細胞樣本不應在臺盼藍溶液中染色超過4分鐘。因此,細胞樣本的染色時間會極大地影響活率計算結果并在樣本之間引入差異。
最后,在之前的報告中也觀察到了儀器引起的對細胞活率的影響。在Chen等(2017)的研究中,作者描述了他們對機械應力誘導的細胞活率降低的觀察和定量分析。作者發現,與基于液流的自動細胞計數儀一起使用時,磷酸鹽緩沖鹽水(PBS)作為稀釋劑會使細胞活率降低,這一現象的原因是系統引入的機械剪切應力。此外,長時間將細胞樣本孵育在PBS中也會使細胞活率降低。作者發現幾種其他的稀釋劑可以在長時間孵育中保持細胞樣本的活率,并提供更加精確的細胞培養條件。
總而言之,能影響活細胞和死細胞計數的方法可以顯著改變細胞活率的結果。重要的是要了解所選細胞計數方法的原理以及過程,包括細胞樣本、細胞樣本制備、細胞計數儀器、試劑、耗材和分析算法等,這些都會引起細胞計數和活率計算的變化。
通過控制策略提高活率測量的置信度
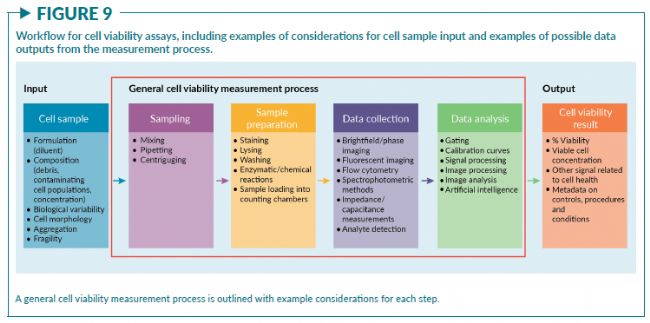
細胞活率測量的一般工作流程可以歸納為幾個關鍵步驟:
- 1)取樣;
- 2)樣本制備;
- 3)數據收集;
- 4)數據處理與分析(圖9)
該過程中的每個步驟都會給測量結果帶來差異。引起差異的來源和差異的水平取決于細胞樣本的屬性以及活率測量方法的類型。控制策略通常會在測量過程中的特定節點實施一種技巧性的操作,用于提高測量結果的置信度。
在研討會上,NIST提出了幾種正在開發中的控制策略,用以提高細胞活率測量,尤其是基于圖像原理的活率測量的置信度。每種方法都建立了一種途徑來應對由測量過程中特定節點引起的潛在變化,例如圖像采集、分析和設門的步驟。通過這些研究,NIST展示了密切觀察測量過程中每一步驟 (即從樣本準備到最終分析)的重要性。這些節點都有可能為測量引入顯著差異和誤差。在這里,我們明確了細胞活率測量過程中每一步驟的潛在差異來源,并給出了NIST正在開發的控制策略的示例。
取樣是細胞活力測量過程中的重要步驟。在此步驟中,通常會從較大體積的細胞中取樣一小部分細胞。如果在此步驟中混勻和移液的操作不當,則用于活率測量的測試樣本可能無法代表原本大體積的樣本,從而破壞了活率測量的相關性。如果細胞樣本中存在聚團,則可能會影響取樣,就需要在樣本制備和數據分析過程中增加其他步驟以解決聚團問題。在這些情況下,控制樣本中的細胞聚團很重要,而且監測聚團細胞百分比可以提示使用者注意測量條件是否存在問題。在采樣步驟中應考慮環境因素,例如溫度和濕度以及樣本的聚集特性。
樣本制備是引起測量差異的另一個重要來源,由于涉及許多手動步驟,通常難以控制。在一些情況下,可以通過自動液體工作站處理樣本(自動化可以集成到數據采集設備中或者是外部獨立的液體處理器)來控制樣本制備,或者通過遵循詳細的樣本制備SOP進行控制。此外,試劑和耗材(例如計數板)也會影響測量質量。樣本制備還可能引起樣品屬性的變化。任何導致細胞死亡的樣本制備步驟對于活率測量尤其成問題,應進行控制以在整個測量過程中保持樣本的穩定性。
數據采集和期間使用的儀器通常是細胞活率測量過程中的黑匣子,特別是當數據采集是自動化或半自動化的情況下。差異來源的控制策略有時是內置在儀器和數據采集流程中的;然而與任何自動化系統一樣,錯誤可能直到測量值超出預期范圍時才被發現(此時,超過預期范圍是由于測量誤差還是細胞樣本真實的生物學現象導致尚不清楚)。常規的儀器驗證和維護可以幫助減少數據采集中的錯誤;然而,確保每一個樣本都被正確分析仍然是一項挑戰。采納測量中過程控制可以幫助在活率分析過程中驗證測量條件。例如,在基于圖像的臺盼藍細胞活率測量中,圖像質量,特別是聚焦和圖像亮度會影響細胞活率測量。在運用自動圖像分析算法之前,圖像必須達到足夠高的質量,這一點至關重要。
NIST演示了一種將少量微珠摻入細胞樣品中的方法,以便在基于細胞計數板的成像細胞活率分析儀(Cellometer Auto 2000,Nexcelom)中進行分析。其中微珠作為獨立于真實細胞樣本的人工制品,用于監控圖像質量。微珠對圖像聚焦變化很敏感,研究人員利用采集的數據表征了微珠的特征與圖像聚焦和亮度之間的關系。在后續細胞活率測量中,微珠可用于尋找一個參考聚焦平面;使用者可借助一種開發出來的工具在每次測量時根據微珠的特征返回到參考的聚焦平面。這種方法提高了從0%活率到接近100%活率的Jurkat細胞樣品中基于臺盼藍自動活率測量的可重復性,并且提高了以人工細胞計數為參照的測量準確性。
在研討會上,NIST提出了幾種正在開發中的控制策略,用以提高細胞活率測量,尤其是基于圖像原理的活率測量的置信度。每種方法都建立了一種途徑來應對由測量過程中特定節點引起的潛在變化,例如圖像采集、分析和設門的步驟。通過這些研究,NIST展示了密切觀察測量過程中每一步驟 (即從樣本準備到最終分析)的重要性。這些節點都有可能為測量引入顯著差異和誤差。在這里,我們明確了細胞活率測量過程中每一步驟的潛在差異來源,并給出了NIST正在開發的控制策略的示例。
取樣是細胞活力測量過程中的重要步驟。在此步驟中,通常會從較大體積的細胞中取樣一小部分細胞。如果在此步驟中混勻和移液的操作不當,則用于活率測量的測試樣本可能無法代表原本大體積的樣本,從而破壞了活率測量的相關性。如果細胞樣本中存在聚團,則可能會影響取樣,就需要在樣本制備和數據分析過程中增加其他步驟以解決聚團問題。在這些情況下,控制樣本中的細胞聚團很重要,而且監測聚團細胞百分比可以提示使用者注意測量條件是否存在問題。在采樣步驟中應考慮環境因素,例如溫度和濕度以及樣本的聚集特性。
樣本制備是引起測量差異的另一個重要來源,由于涉及許多手動步驟,通常難以控制。在一些情況下,可以通過自動液體工作站處理樣本(自動化可以集成到數據采集設備中或者是外部獨立的液體處理器)來控制樣本制備,或者通過遵循詳細的樣本制備SOP進行控制。此外,試劑和耗材(例如計數板)也會影響測量質量。樣本制備還可能引起樣品屬性的變化。任何導致細胞死亡的樣本制備步驟對于活率測量尤其成問題,應進行控制以在整個測量過程中保持樣本的穩定性。
數據采集和期間使用的儀器通常是細胞活率測量過程中的黑匣子,特別是當數據采集是自動化或半自動化的情況下。差異來源的控制策略有時是內置在儀器和數據采集流程中的;然而與任何自動化系統一樣,錯誤可能直到測量值超出預期范圍時才被發現(此時,超過預期范圍是由于測量誤差還是細胞樣本真實的生物學現象導致尚不清楚)。常規的儀器驗證和維護可以幫助減少數據采集中的錯誤;然而,確保每一個樣本都被正確分析仍然是一項挑戰。采納測量中過程控制可以幫助在活率分析過程中驗證測量條件。例如,在基于圖像的臺盼藍細胞活率測量中,圖像質量,特別是聚焦和圖像亮度會影響細胞活率測量。在運用自動圖像分析算法之前,圖像必須達到足夠高的質量,這一點至關重要。
NIST演示了一種將少量微珠摻入細胞樣品中的方法,以便在基于細胞計數板的成像細胞活率分析儀(Cellometer Auto 2000,Nexcelom)中進行分析。其中微珠作為獨立于真實細胞樣本的人工制品,用于監控圖像質量。微珠對圖像聚焦變化很敏感,研究人員利用采集的數據表征了微珠的特征與圖像聚焦和亮度之間的關系。在后續細胞活率測量中,微珠可用于尋找一個參考聚焦平面;使用者可借助一種開發出來的工具在每次測量時根據微珠的特征返回到參考的聚焦平面。這種方法提高了從0%活率到接近100%活率的Jurkat細胞樣品中基于臺盼藍自動活率測量的可重復性,并且提高了以人工細胞計數為參照的測量準確性。
細胞活率測量的對照材料
對照材料,如商品化的參考微珠和實驗室制備的固定死細胞樣本,可用于建立細胞活率測量中的控制策略。根據選擇的測量方法,這些材料會有非常具體的應用。參考微珠的優點是穩定性好,可以在市場上買到,而且在不同實驗室之間可以保證品質的均一。微珠材料可用于建立儀器驗證方法,或者如前所述,用于在測量過程中對測量質量進行的基準化分析。模擬細胞屬性(例如散射性和染色特性)的新型合成參考材料也可以用作測量過程控制,以解決由過程(例如細胞染色)和數據分析(例如細胞設門)引起的差異性來源。
固定細胞材料也可以作為一種方便的工具來模擬樣本的特定屬性,如流式細胞術中的散射特性或成像方法中的染色特性。細胞可以保留特定的細胞特征,如形態和表面標記物。對于基于細胞核染色的活率分析方法,固定細胞尤其有吸引力,因為固定可以保存細胞的核物質,并使其可用于評估膜的滲透性。由于固定細胞的許多特性可能與測試細胞非常相似,也許可以與目標細胞相同的方式對它們進行采樣、染色、處理和測量。在實用性方面,固定細胞材料可以大批量生產,并有可能儲存很長時間。
死亡和瀕死細胞材料是細胞活率測量的一類重要生物參考材料。死細胞或瀕死細胞的外參研究(即恢復研究)對于評估細胞活率測量的特異性、線性和靈敏度至關重要。有多種方法可用來獲得死亡或瀕死細胞材料,包括熱休克、固定、受限的環境生長條件、營養剝奪和化學處理。這些材料通常是臨時制備的,因為它們可能不具備長期存儲所需的穩定性。重要的是,用于殺死或損傷細胞的不同方法會導致死細胞的不同屬性。例如,一些殺傷方法可能會造成更多的細胞碎片,而另一些方法可能會使細胞失去活性,但仍然保持相當的完整性和均勻性。值得注意的是,對照材料的屬性范圍應該與待測細胞樣本的屬性范圍一致。例如,如果需要在生物制造過程的特定步驟中分析細胞活率,則可以根據細胞在此過程的上一步中可能遇到的干擾類型(例如流體應力、環境條件、或營養狀況)來確定對照物質。即使在特定CTP的制造過程中,也尚未有任何一類參考物質被認證可充分代表用于活率測量的各種類型的細胞樣本。實驗室制備死亡或瀕死細胞控制材料的最佳方案和指導原則將有助于支持細胞活率測量控制策略的實施。
固定細胞材料也可以作為一種方便的工具來模擬樣本的特定屬性,如流式細胞術中的散射特性或成像方法中的染色特性。細胞可以保留特定的細胞特征,如形態和表面標記物。對于基于細胞核染色的活率分析方法,固定細胞尤其有吸引力,因為固定可以保存細胞的核物質,并使其可用于評估膜的滲透性。由于固定細胞的許多特性可能與測試細胞非常相似,也許可以與目標細胞相同的方式對它們進行采樣、染色、處理和測量。在實用性方面,固定細胞材料可以大批量生產,并有可能儲存很長時間。
死亡和瀕死細胞材料是細胞活率測量的一類重要生物參考材料。死細胞或瀕死細胞的外參研究(即恢復研究)對于評估細胞活率測量的特異性、線性和靈敏度至關重要。有多種方法可用來獲得死亡或瀕死細胞材料,包括熱休克、固定、受限的環境生長條件、營養剝奪和化學處理。這些材料通常是臨時制備的,因為它們可能不具備長期存儲所需的穩定性。重要的是,用于殺死或損傷細胞的不同方法會導致死細胞的不同屬性。例如,一些殺傷方法可能會造成更多的細胞碎片,而另一些方法可能會使細胞失去活性,但仍然保持相當的完整性和均勻性。值得注意的是,對照材料的屬性范圍應該與待測細胞樣本的屬性范圍一致。例如,如果需要在生物制造過程的特定步驟中分析細胞活率,則可以根據細胞在此過程的上一步中可能遇到的干擾類型(例如流體應力、環境條件、或營養狀況)來確定對照物質。即使在特定CTP的制造過程中,也尚未有任何一類參考物質被認證可充分代表用于活率測量的各種類型的細胞樣本。實驗室制備死亡或瀕死細胞控制材料的最佳方案和指導原則將有助于支持細胞活率測量控制策略的實施。
細胞活率測量標準的開發
如前所述,許多研討會的參與者都表達了制定細胞活率標準的需求。最近發布的ISO 20391細胞計數標準系列中已涉及細胞活率,并且在一些領域、儀器或特定細胞類型方面的細胞計數和活率標準已經存在或正在開發中。例如,ASTM最近致力于開發一種測量支架中細胞活率的測量方法(ASTM WK62115,“測量支架中細胞活力的新測量方法”)。在國際標準組織 (ISO) 生物技術委員會(TC)的ISO TC 276中,分析方法工作組正處于完成有關細胞治療產品(CTP)表征和測試的標準的最后階段,“ ISO / DIS 23033生物技術-分析方法-表征和檢測細胞治療產品的一般準則”。該標準將細胞活率確定為CTP檢測中非常重要的質量屬性,并建立了對最終CTP中細胞活率測量的要求。該標準還提供了適用于選擇和開發用于CTP表征和檢測的分析方法的通用指南,以及方法確認和驗證的注意事項和要求;但是,它沒有為細胞活率的測量提供具體參考。
目前,還沒有形成統一的標準用以制定細胞活率相關的術語,和指導fit-for-purpose的細胞活率測量方法的開發。一個更通用的,可以兼顧fit-for-purpose考量和最佳可行性方案的細胞活率測量標準將能夠滿足相關人員的需求,也將最適合于涉及到廣泛用途和細胞類型的CTP行業。細胞活率的通用標準需要明確細胞活率的定義和活率結果報告的相關術語。細胞活率的結果報告應包含測量使用的方法和所測生物指標的信息。例如,當報告一個細胞樣本的活率為70%時,需附加更具體的信息(比如用基于成像分析原理的臺盼藍排除法測得)。只有明確了所使用的測量方法,細胞活率結果之間才具有可比性,也才可將結果用于合適的用途。
通用標準還應能解決與細胞樣本相關的常見挑戰,包括諸如細胞群體異質性,樣本穩定性以及污染碎片和細胞類型等。這些屬性都有可能對活率測量方法產生影響。通用標準需要明確的另一個關鍵方面是測量控制策略,包括控制材料的適當使用和制備,以及用于驗證所選測量過程的方法,這是需要相關人員進一步考慮的重要領域。使用不同儀器和原理(例如基于流式細胞儀、成像、電阻抗、代謝物的測定等)測量細胞活率的一般考慮因素也需要被共享。此外,通用標準應包含如何比較不同活率測量方法,以及如何評估所選方法的適用性的實驗框架和指導原則。
目前,還沒有形成統一的標準用以制定細胞活率相關的術語,和指導fit-for-purpose的細胞活率測量方法的開發。一個更通用的,可以兼顧fit-for-purpose考量和最佳可行性方案的細胞活率測量標準將能夠滿足相關人員的需求,也將最適合于涉及到廣泛用途和細胞類型的CTP行業。細胞活率的通用標準需要明確細胞活率的定義和活率結果報告的相關術語。細胞活率的結果報告應包含測量使用的方法和所測生物指標的信息。例如,當報告一個細胞樣本的活率為70%時,需附加更具體的信息(比如用基于成像分析原理的臺盼藍排除法測得)。只有明確了所使用的測量方法,細胞活率結果之間才具有可比性,也才可將結果用于合適的用途。
通用標準還應能解決與細胞樣本相關的常見挑戰,包括諸如細胞群體異質性,樣本穩定性以及污染碎片和細胞類型等。這些屬性都有可能對活率測量方法產生影響。通用標準需要明確的另一個關鍵方面是測量控制策略,包括控制材料的適當使用和制備,以及用于驗證所選測量過程的方法,這是需要相關人員進一步考慮的重要領域。使用不同儀器和原理(例如基于流式細胞儀、成像、電阻抗、代謝物的測定等)測量細胞活率的一般考慮因素也需要被共享。此外,通用標準應包含如何比較不同活率測量方法,以及如何評估所選方法的適用性的實驗框架和指導原則。
結語
隨著近年CTP在提供挽救生命的治療方面的成功,合適和可靠的細胞活率測量變得至關重要。本次研討會將工業界、學術和政府實驗室的相關人員聚集在一起,共同探討了當前CTP活率測量領域面臨的挑戰,和提高活率測量的置信度的可能方法。研討會參與者確定了fit-for-purpose的細胞活率方法開發的關鍵考慮因素,如樣本屬性、測量方法,以及用于識別活細胞和死細胞的生物指標的選擇。重要的是,樣本屬性和許多測量過程的步驟之間會發生相互作用,這些作用在開發準確的、能反映樣本真實狀態的分析方法時是必須著重考慮的。研討會上的一項重要共識是需要確定fit-for-purpose的測量方法,這些方法將為細胞的既定用途提供最相關的活率信息。細胞活率結果報告應包含測量方法以及計算公式的描述。此外,對照材料和對照研究的應用被證明具有提高細胞活率測量置信度的潛力。一套支持選擇、開發和驗證fit-for-purpose的細胞活率測量方法的標準將有助于加速CTP的開發。
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





