飲食熱量限制對記憶性T細胞的調(diào)節(jié)作用
熱量限制(Caloric restriction,CR)是指在沒有營養(yǎng)不良或不缺乏維生素、礦物質(zhì)或氨基酸的情況下,減少熱量攝入。好處包括延長壽命、改善代謝狀況,以及減少心血管疾病、神經(jīng)退行性變、基本炎癥水平和某些類型癌癥的發(fā)病率。
CR對CD4和CD8記憶T細胞的遷移、內(nèi)在細胞狀態(tài)和功能有顯著的影響。
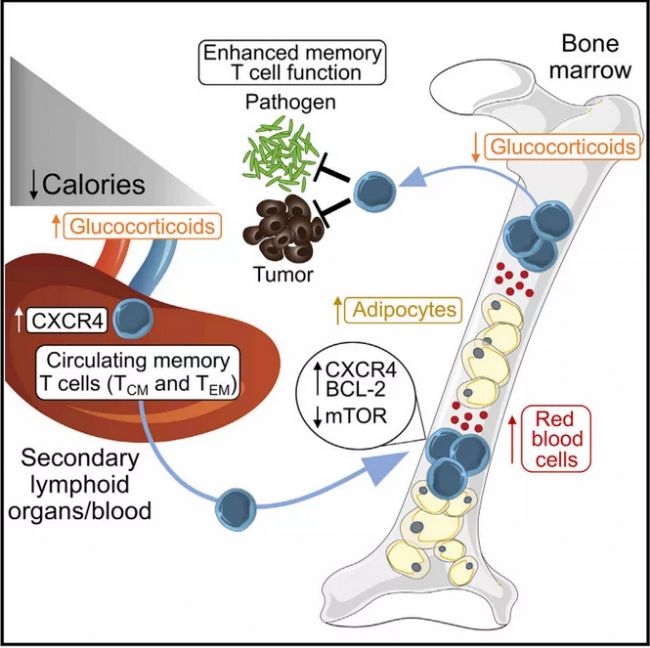
在小鼠中,50%的CR可以誘導循環(huán)記憶T細胞從次級淋巴組織和血液重新分布到骨髓(BM)。CR期間,幼稚的B細胞和單核細胞也會在BM中積累,這個Niche可能作為免疫細胞的“避風港”或“代謝避難所”。
記憶T細胞的再分配是由類固醇激素、糖皮質(zhì)激素協(xié)調(diào),它們可以誘導BM同源受體CXCR4在T細胞上的表達。與此同時,在CR期間對BM進行了大量的重塑,以富集T細胞營養(yǎng)因子、紅細胞和脂肪細胞,所有這些都能協(xié)同招募、保留和保護記憶T細胞。
在CR治療過程中,BM脂肪細胞是一個重要的激素來源,可以彌補外周白脂肪組織(WAT)的損失。外周WAT是感染清除后記憶T細胞主要儲存部位。在外周WAT中,記憶T細胞表現(xiàn)穩(wěn)態(tài)增殖增加,增強的效應功能和脂肪酸的利用。
飲食限制誘導記憶T細胞回到骨髓(文獻1)
雖然CR對宿主的生理學產(chǎn)生了一些有益的改變,在這種背景下,降低mTOR信號可能是增強記憶T細胞功能的核心。rapamycin降低mTOR信號,可誘導細胞進入CR狀態(tài),在病毒感染時足以增強記憶T細胞的發(fā)展、維持和保護功能。
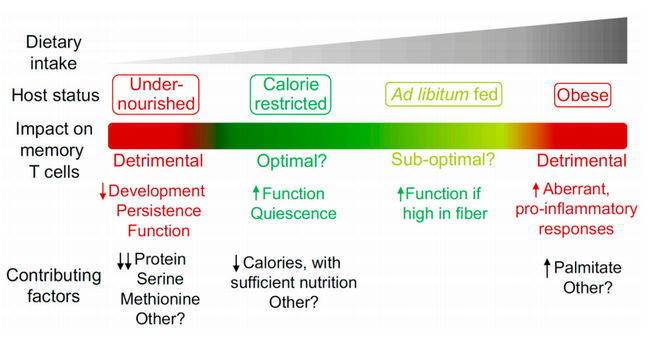
總的來說,低食物攝入和充足的營養(yǎng),可能是促進壽命和一般健康狀況的理想狀態(tài)。但是CR期間,記憶T細胞所使用的代謝途徑和燃料來源仍然不清楚;此外CR的持續(xù)時間和程度,也沒有系統(tǒng)評估;CR的干預方式;使用年齡(老年顯示CR沒有明顯效果),因而合理使用依舊需要大量研究。
營養(yǎng)不良和食物代謝物減少
雖然減少熱量攝入,會增加記憶T細胞的功能,但如果食物攝入嚴重減少,營養(yǎng)不足就會嚴重危害免疫系統(tǒng)。營養(yǎng)不良與慢性感染、低級別炎癥狀態(tài)、腸道滲透性增加和腸道微生物群的生物失調(diào)相關。
飲食蛋白質(zhì)嚴重減少(0.6%,對照飲食為18%),導致蛋白質(zhì)能量營養(yǎng)不良( protein energy malnutrition,PEM),大大降低記憶CD8T細胞長期存在的能力。
膳食代謝產(chǎn)物,如絲氨酸是效應CD8T細胞增殖和功能所必需的。在無絲氨酸飲食的條件下的T細胞激活,記憶T細胞的發(fā)育會減少。在增殖過程中,絲氨酸是合成核苷酸所必需的,這突出了該代謝物在T細胞生物學中的基本作用。其他促進T細胞激活的代謝物還包括蛋氨酸。L-精氨酸調(diào)節(jié)CD4T細胞的幾種代謝途徑。
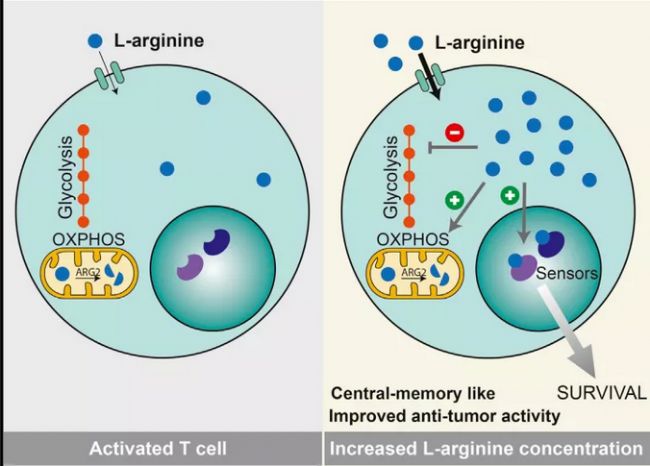
亮氨酸促進T細胞激活和抗腫瘤活性(文獻2)
飲食誘導肥胖
肥胖與代謝綜合征和慢性低等級炎癥有關。可以確認,肥胖會引起異常的T細胞激活和T細胞記憶反應。但是到底是有利還是有弊,需要看具體的場景。肥胖引起的記憶T細胞促炎癥的特點,會引起機體免疫病理損傷;但是促炎癥的特點,在某些條件下可以增強抗腫瘤的治療效果。
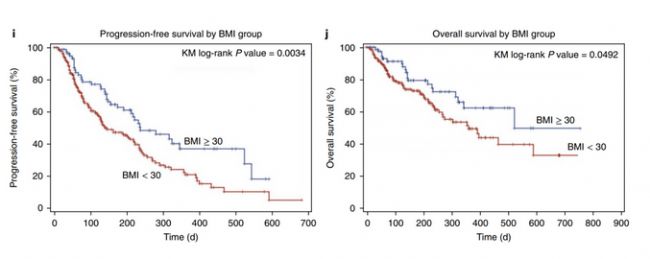
PD-1/PD-L1阻斷,高BMI組PFS和OS更高(文獻4)
膳食纖維
膳食的攝入量和成分是導致腸道微生物群改變的主要原因。微生物群包括數(shù)以億種與人類共同進化的有益細菌,幾乎影響了宿主生理學的所有方面。
腸道微生物群能夠?qū)⑸攀忱w維的成分消化成短鏈脂肪酸(SCFAs)。食用高纖維的飲食對健康有益,如預防肥胖、結(jié)腸癌、十二指腸潰瘍、糖尿病、中風、高血壓和心血管疾病。
在免疫反應方面,醋酸、丙酸和丁酸鹽由菌群大量產(chǎn)生,具有強大的免疫調(diào)節(jié)作用,對各種CD4T細胞群的發(fā)育和功能至關重要。
微生物群產(chǎn)生的SCFAs可以輔助CD8+T細胞激活,及向記憶CD8T細胞的發(fā)育,并維持期存活。代謝產(chǎn)生的丁酸鹽至關重要,通過促進效應CD8+T細胞中的線粒體氧化代謝,誘導記憶程序。
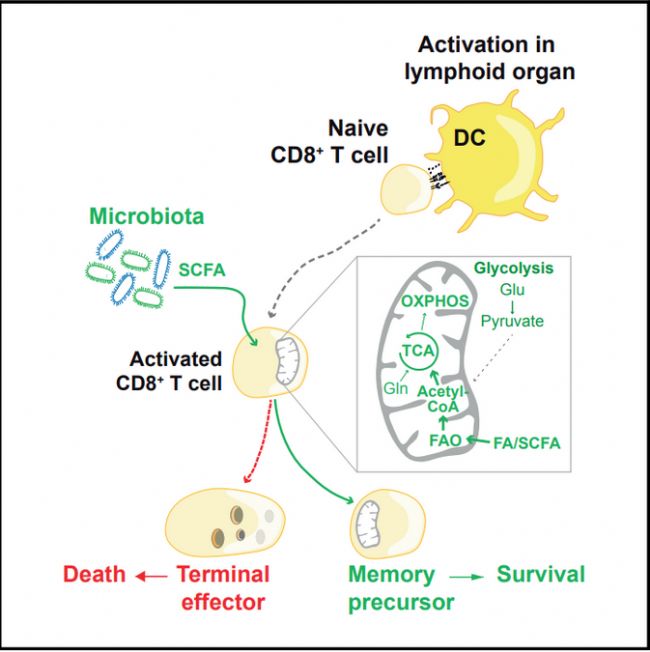
SCFAs激活T細胞,促進記憶表型發(fā)育(文獻3)
喵評:平衡飲食是關鍵。過多過少,偏向飲食都要糾正。
主要參考文獻
-
Collins et al., The Bone Marrow Protects and Optimizes Immunological Memory during Dietary Restriction,2019, Cell 178, 1088–1101
-
Geiger, R.; Rieckmann, J.C.; Wolf, T.; Basso, C.; Feng, Y.; Fuhrer, T.; Kogadeeva, M.; Picotti, P.; Meissner, F.; Mann, M.; et al. L-Arginine Modulates T Cell Metabolism and Enhances Survival and Anti-tumor Activity. Cell 2016, 167, 829–842.e13.
-
Bachem et al.,Microbiota-Derived Short-Chain Fatty Acids Promote the Memory Potential of Antigen-Activated CD8+ T Cells 2019, Immunity 51, 285–297
-
Wang, Z.; Aguilar, E.G.; Luna, J.I.; Dunai, C.; Khuat, L.T.; Le, C.T.; Mirsoian, A.; Minnar, C.M.; Stoffel, K.M.; Sturgill, I.R.; et al. Paradoxical effects of obesity on T cell function during tumor progression and PD-1 checkpoint blockade. Nat. Med. 2019, 25, 141–151