二血管阻塞慢性腦缺血模型的制作
二血管阻塞慢性腦缺血模型
本文介紹模擬慢性腦血流低灌注所致病理生理改變及認知障礙的嚙齒類動物模型,包括大鼠雙側頸總動脈結扎和小鼠雙側頸總動脈狹窄模型。其中,大鼠雙側頸總動脈結扎模型通過結扎大鼠雙側頸總動脈實現,小鼠雙側頸總動脈狹窄通過在小鼠的雙側頸總動脈植入鋼制線圈實現。結扎大鼠雙側頸總動脈造成腦血流的下降并能較好模擬慢性缺血所致的病理改變,操作簡單、重復性好、死亡率低,被廣泛用于慢性腦缺血的研究。該模型可造成脫髓鞘改變、軸突丟失、膠質細胞增生等白質損傷的病理改變。
此外,將結扎大鼠雙側頸總動脈與降低平均動脈壓(降至50mmHg)結合,并在缺血10~30min后重新恢復血供,可用于模擬前腦缺血。該模型可引起腦內易感腦區神經元的選擇性、延遲性死亡,包括新皮質、海馬CA1區的錐體神經元以及尾側殼核。其中,海馬神經元損傷與記憶受損及認知障礙密切相關。該模型所致的神經元選擇性損傷可通過組織學和行為學檢測方法進行評估。二血管結扎模型手術步驟簡單、再灌注操作容易,故較四血管結扎模型更具優勢。
一、動物選擇
大鼠
- 在建立大鼠二血管結扎的動物模型時,必須考慮動物的品系、性別以及年齡。由于雌激素對缺血結果有影響,通常選用雄性大鼠。在二血管結扎的動物模型中,最常用的動物是250~300g的雄性 Wistar大鼠。Sprague-Dawley(SD)大鼠和其他品系的大鼠亦可用于本模型的制作。
小鼠
- 常采用雄性C57BI/6小鼠,體重為24-30g。此外,沙鼠是較為常用的品系。由于轉基因和基因敲除小鼠大多來源于C57BI/6品系,為了研究基因在慢性腦缺血病理生理機制中發揮的作用,故目前多用C57BI/6小鼠制作該動物模型。
二、制作步驟
1.大鼠手術操作步驟
- 所有操作均在無菌條件下進行。手術人員應戴口罩和無菌手套,穿無菌隔離衣。術前所有手術器械均應滅菌且在手術過程中存放在無菌溶液中,如惡霉靈溶液。
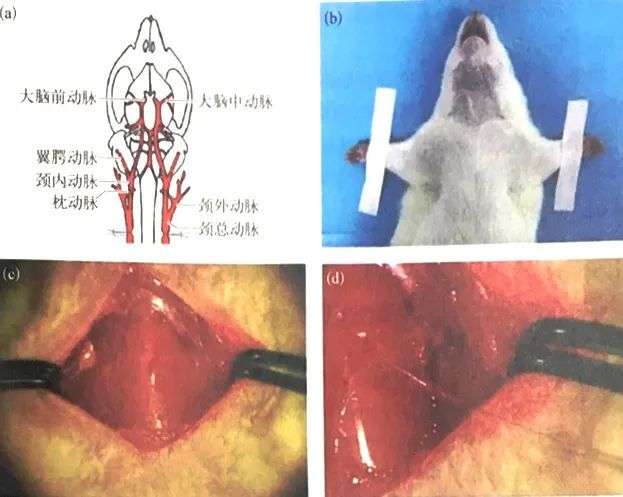
(a)大鼠頭頸部血管及結扎部位示意圖;
(b)動物呈仰臥位;
(c)頸部正中切口,暴露氣管和雙側頸總動脈,用眼科鑷分離并挑起頸總動脈;
(d)暴露一側頸總動脈,將一根外科絲縫線結扎頸總動脈用同樣的方法分離并結扎另一側頸總動脈
(1)將大鼠放入麻醉箱中,用含2%異氟醚的70%氧化亞氮和30%氧氣的混合氣體以5L/min的氧氣流速進行麻醉誘導,3~5min后,大鼠進入麻醉狀態,之后以1L/min的氧氣流速進行維持。
(2)術前褪毛,聚維酮碘常規消毒手術區域。
(3)為了控制平均動脈壓、動脈血氣量和血糖含量,應同時行尾動脈插管。把2根電極通過小的皮膚切口插入雙側顳肌,以獲取腦電圖。在整個實驗中,平均動脈血壓和腦電圖的獲取依賴動力實驗系統。
(4)通過尾動脈抽取動脈血,運用動脈血氣體分析儀和血漿葡萄糖測定儀,對血氣和血糖含量進行測定。
(5)在缺血前15min和缺血后15min對動脈血氣和血糖含量進行測定,在整個實驗過程中血液氣體含量都保持在正常的生理范圍內。
(6)在大鼠腹側頸部皮膚正中線處做一個切口,小心分離兩側的頸總動脈和周圍組織以及迷走神經。
(7)把直腸溫度探測器插入到直腸中監測體溫。熱電耦33G溫度探測器植入顳肌,監測頭部溫度。在動物身體和頭部上方的熱光源的幫助下,身體和頭部溫度在整個手術過程中保持在(37±0.2)℃。
(8)當所有的準備工作已經完成時,異氟醚的濃度保持在1%。
(9)在缺血前15min,監測血壓中的氣體含量,平均動脈血壓、腦電圖、直腸和頭部溫度,并且保持在正常的生理范圍內。
(10)將兩側頸總動脈通過外科絲縫線5-0結扎以誘導腦血流低灌注。
(11)縫合皮膚,結束麻醉過程。大鼠仍然需要進行70%氧化亞氮和30%氧氣的混合氣體輔助呼吸,并且保持顳肌和直腸的溫度在37℃,直到它從麻醉狀態清醒過來,此過程通常需要30~60min。移除頭部和直腸溫度探測器后,把大鼠放回到其原來的籠子。
(12)密切監控大鼠呼吸,直到呼吸恢復平穩。1~2h后,大鼠可以轉移至動物房,常規供應食物和水。
(13)頸總動脈閉塞分步法:為避免腦血流量突然出現相對嚴重的下降,可按以下步驟逐步閉塞頸總動脈。大鼠用異氟醚麻醉,頸腹正中切口。暴露左側頸總動脈,與迷走神經輕輕分離,用三條結扎線(2-0)閉塞。1周后,做一個新的切口,右頸動脈同樣被阻塞。
2.小鼠手術操作步驟
- 由于小鼠不能結扎雙側頸總動脈,在小鼠腹側頸部皮膚正中線處作一個切口,手術顯微鏡下小心分離兩側的頸總動脈和周圍組織以及迷走神經。用內徑0.18~0.22mm、長度2.5mm的特制鋼制微線圈分別纏繞在雙側頸總動脈分叉部的近心端以誘導腦血流低灌注。縫合皮膚,結束麻醉過程。小鼠仍然需要進行70%/30%的氧化亞氮/氧氣輔助呼吸,并且保持顳肌和直腸溫度在37℃,直到它從麻醉狀態清醒過來,此過程通常需要30~60min。密切監控小鼠呼吸,直到呼吸恢復平穩。30~60min后,小鼠可以放回籠中,常規供應食物和水。因小鼠的Wlls環后交通動脈常缺如,同時結扎雙側頸總動脈,因椎基底動脈系統血流不能代償頸動脈系統腦血流的劇烈下降,至腦組織缺血缺氧,極易造成動物的迅速死亡。
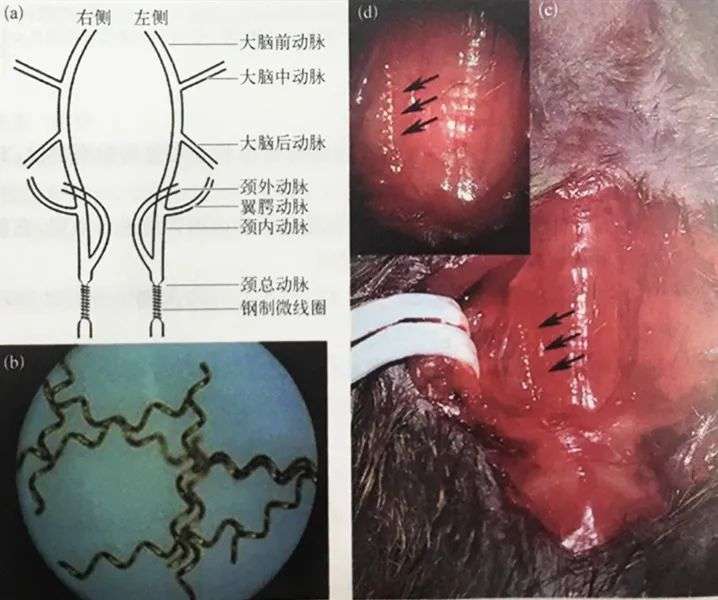
(a)小鼠頭頸部血管及鋼制微線圈置入部位示意圖;
(b)鋼制微線圈實物圖;
(c)頸部正中切口暴露氣管和右側頸總動脈,用眼科鑷分離并挑起右側頸總動脈將鋼制微線圈纏繞在頸總動脈分叉部的近心端;
(d)顯微鏡下
(e)圖的放大圖,箭頭所指即鋼制微線圈
三、注意事項及常見問題解答
1.注意事項
- 以下要點對于二血管結扎的慢性腦缺血模型組織損傷的重復性非常重要:
- 在手術過程中,直腸和大腦的溫度必須控制在(37±0.2)℃。大腦的溫度尤其重要,因為沒有血供會引起大腦溫度的下降;而大腦溫度的微小變化對于缺血引起的組織學損傷會產生顯著的影響。
- 手術前夜對小鼠禁食以維持血糖水平的穩定同樣非常重要。卒中前高水平血糖通常會引起更加嚴重的神經元損傷。
2.常見問題及解決方法
- 死亡大部分是由于術后并發癥所導致。頸總動脈和迷走神經分離不清,誤傷迷走神經導致動物呼吸困難。手術時間過長和手術過程中的不仔細同樣會引起功能修復困難。此外,過度麻醉會引起動物在手術時死亡(如何讓動物實驗安全平穩進行,點擊查看解決方案)。因此,熟練操作,仔細分離頸總動脈是提高生存率的重要因素。
*以上內容部分源自《實驗卒中模型方法學》
書號:ISBN 978-7-313-21776-9
了解更多卒中造模方法
歡迎掃碼咨詢






