應用案例|活體近紅外二區聚甲川熒光染料多色融合成像
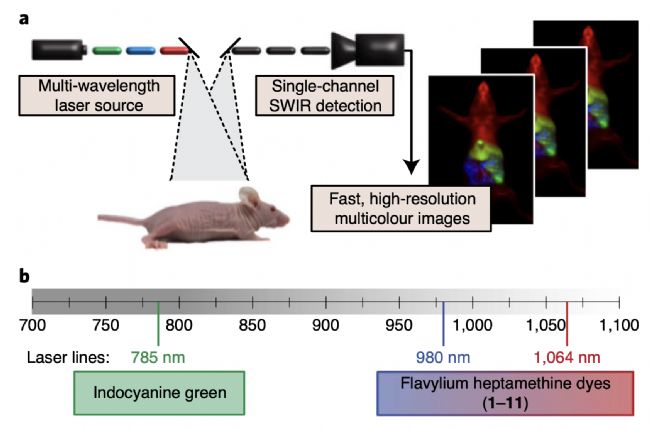
圖1:紅外二區活體成像:多色熒光融合技術
熒光成像技術使得人類對細胞和微生物的研究能力得到革命性提升,高分辨率多路復用技術是細胞成像的主要手段,然而將該技術應用于哺乳動物身上卻有很大挑戰性,這是因為傳統的熒光成像激發光位于可見光區域(VIS,350-700nm),而哺乳動物組織在可見光區域以及近紅外一區(NIR-I,700-1000nm)有較大的散射和自體熒光。在近紅外二區(NIR-Ⅱ,1000-1700nm),動物組織光散射與自體熒光大大減少,同時成像深度隨波長增加而增加,因此極大提高了成像的空間分辨率。本文作者選擇吸收和發射帶較窄的花菁染料(Flav)進行結構改造,開發出11個含有不同取代基的染料(如下圖1a),采用與傳統多路復用使用同一激發波長不同檢測窗口相反的方式,作者采用了不同激發波長去激發相匹配的化合物,使用一個InGaAs檢測器來接收信號的方式避免了傳統方法多通道檢測導致分辨率差異的問題。通過從11個化合物中篩選出兩個性能最好的染料分別匹配980nm和1064nm的激發波長,結合臨床已批準使用的吲哚菁綠(ICG),本文作者實現了實時、三色的高時空分辨成像。
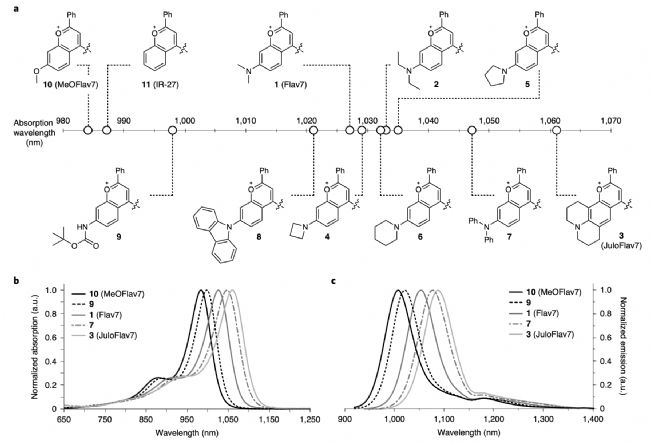
圖2:a)不同取代基取代的黃酮類花菁染料;b)和c)分別為對應化合物的吸收與發射圖譜。
首先作者選擇了980nm和1064nm的激光,一方面是因為這些激光器成本低容易獲得,另一方面多通道檢測要求兩個通道之間至少間隔80nm的波長范圍。通過比較作者選擇了化合物3(JuloFlav7)用于匹配1064nm激發,化合物10(MeoFlav7)用于匹配980nm激發,ICG則使用785nm的光激發。為了實現實時成像,將毫秒級的觸發信號獨立發送到每個連續波激光器,并對探測器進行編程,為每一個序列的激發脈沖收集單一幀。作者將化合物3和化合物10用聚乙二醇膠束促溶,分別對比了在有機相和水相的三色成像,發現被膠束促溶后的探針并不影響成像效果。隨后作者在小鼠體內腹腔注射MeoFlav7,2min后靜脈注射JuloFlav7,最后在4min時注射ICG,如圖2g所示,實時多色成像顯示出了不同探針在小鼠體內不同部位的相對分布。
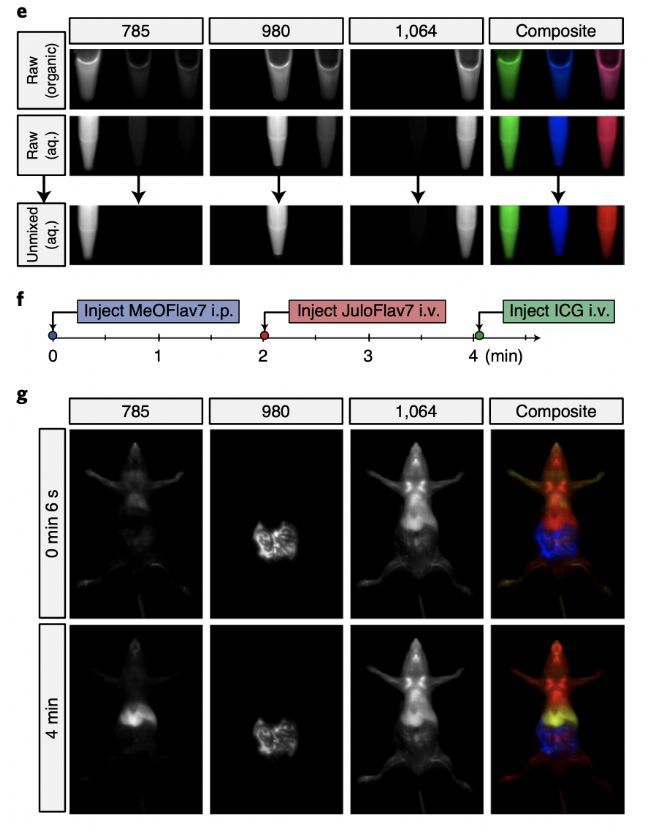
圖3:e)三種探針在有機相(上)和水相(中)以及線性分離矯正的三色成像;f)注射三種探針的時間線;g)使用785、980和1064 nm激發波長激發和1150-1700 nm范圍采集(10ms曝光時間,27.8 fps)的體內多路復用圖像。
隨后作者探索了實時近紅外多色成像的應用。心跳速率、呼吸速率、溫度調節、代謝以及中樞神經系統功能受麻醉的影響甚大,觀測動物的自然狀態對研究生理學是必須的,目前僅限于遙感裝置和心電圖以及植入裝置等手段。快速NIR-II實時成像使得無接觸觀測蘇醒小鼠的生理狀態得以實現。由于幀速率比動物的宏觀運動更快,因此可以量化清醒動物的心率和呼吸速率。在腹腔注射MeOFlav7和連續靜脈注射JuloFlav7和ICG的80分鐘后進行清醒的小鼠成像。如下圖3a所示,可以在3.2s內看到小鼠的頭部的移動軌跡變化,同時通過量化感興趣區域肝臟的運動測量出小鼠的心率為247/min(圖3b)。隨后作者利用兩個探針ICG和JuloFlav7在肝臟的積累與分布來評估兩個探針的生物分布和清除特性,如圖3c和d所示,ICG一小時內信號逐漸降低,而JuloFlav7的信號基本保持不變。
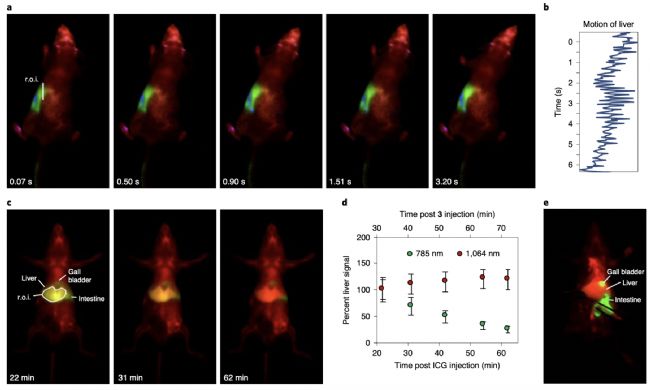
圖4:a)三色多路復用成像;b)清醒小鼠的心率測量;c)JuloFlav7系統標記ICG清除成像;d)1h內的ICG與JuloFlav7的信號百分率;e)雙色活檢成像
熒光成像引導的手術過程中,區分與癌癥有關的前哨淋巴結和評估淋巴血管疾病中淋巴網絡的結構和功能對癌癥治療極為重要。本文作者預先在小鼠足和尾巴皮下注射ICG,40min后ICG聚集在淋巴系統中,隨后JuloFlav7膠束靜脈注射并立即成像,如圖4所示,可以看到在30s左右JuloFlav7顯示出大多數血管,與淋巴組織區別開來。這種鑒別淋巴和循環系統并同時監測其功能的能力在非侵入性診斷和擴大熒光引導手術方面具有非凡的意義。
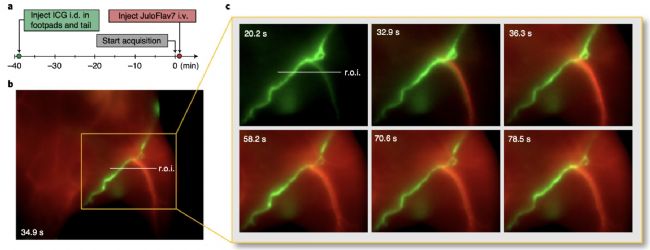
圖5:a)注射不同探針的時間線;b)注射JuloFlav7膠束30s后的成像;c)不同時間點的局部放大圖片
參考文獻:
Cosco E D, Spearman A L, Ramakrishnan S, et al. Shortwave infrared polymethine fluorophores matched to excitation lasers enable non-invasive, multicolour in vivo imaging in real time[J]. Nature Chemistry, 2020, 12(12): 1123-1130.
⭐ ⭐ ⭐
紅外二區小動物活體熒光成像系統 - MARS
NIR-II in vivo imaging system
高靈敏度 - 采用Princeton Instruments深制冷相機,活體穿透深度高于15mm
高分辨率 - 獨家定制高分辨大光圈紅外鏡頭,空間分辨率優于3um
熒光壽命 - 分辨率優于 5us
高速采集 - 速度優于1000fps (幀每秒)
多模態系統 - 可擴展X射線輻照、熒光壽命、一區熒光成像、原位成像光譜,CT等
顯微鏡 - 紅外二區高分辨顯微系統,兼容成像型光譜儀





