Piggybac轉座子載體的作用原理和應用

在我們研究某種疾病的發(fā)病機制或者某種藥物的作用靶點時,經常需要建立目的基因過表達或基因敲除的細胞模型,目前構建穩(wěn)轉細胞株及部分敲除細胞株最常用的方式之一是慢病毒法,慢病毒因其可以轉染幾乎所有種類的細胞,且在轉染后可以整合到細胞的基因組而長期表達的優(yōu)勢,是目前較為主流的構建方法,但慢病毒構建的穩(wěn)轉細胞株相對于野生型沒有生長優(yōu)勢;此外,慢病毒對目的基因的載量也有限。因此,尋找一種高效簡便可替代慢病毒法的方法顯得尤為重要。
轉座子的出現(xiàn)為構建基因編輯細胞株提供了一個全新的視野。轉座子也被稱為跳躍基因,由Barbara McClintock教授在上世紀50年代發(fā)現(xiàn),并于1983年因此發(fā)現(xiàn)而獲得諾貝爾醫(yī)學獎,是指一段DNA序列由基因組的一個位置跳躍到另一個位置。轉座子主要包含兩種類型:
☑ 一類轉座子:逆轉座子(retrotransposons),自身不表達轉座酶,先轉錄為RNA,通過RNA的反轉錄獲得cDNA,cDNA在整合酶的作用下轉移到其他基因組位置。
☑ 二類轉座子:DNA轉座子(DNA transposons),通過自身編碼的轉座酶直接切割轉座子所在DNA序列,實現(xiàn)序列的轉移。在脊椎動物中發(fā)現(xiàn)的轉座子系統(tǒng)中,以睡美人轉座子(SleepingBeauty)和piggyBac轉座子等DNA轉座子最為常見。
睡美人轉座子是由科學家Levis于1997年在脊椎動物中首個發(fā)現(xiàn)的轉座子, 其通過生物信息學方法分析8種鮭魚中12個Tc1類轉座酶序列,找出了其中的保守序列,確定了已經滅絕的鮭魚中具有活性的轉座酶的基因序列,并稱其為睡美人轉座子。但睡美人轉座子對宿主要求嚴格,且存在轉座效率不穩(wěn)定等情況,限制了其廣泛應用,而piggyBac轉座子則因其特異的整合位點、精密切割以及廣泛存在的特性被大家所青睞。
PiggyBac轉座子結構與機制
PiggyBac轉座子(粉紋夜蛾)是一個2475bp長的可自主轉移元件,兩末端分別有一個由13bp和19bp的TIR序列組成的亞末端重復序列,兩端TIR序列之間的間隔分別是3bp(5’端)和31bp(3’端),在兩個亞末端重復序列之間,有一個1.8kb的開放閱讀框,編碼由594個氨基酸組成、分子量大小為64KD的PiggyBac轉座酶。如下圖所示:
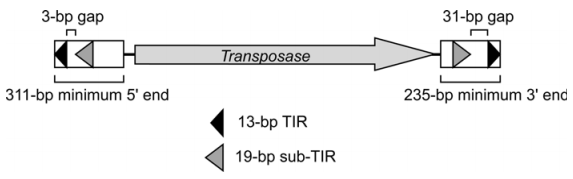
PiggyBac屬于II類轉座子,通過“剪切-粘貼”機制移動,即從基因組一個位置轉座到另一個位置,不留下序列本身(與I類啟動子通過“復制-粘貼”的移動方式不同)。
通過對PiggyBac超家族成員序列比對結果分析,發(fā)現(xiàn)PiggyBac轉座酶保守的氨基酸位點為D268、D346和D447,與許多其它的轉座酶和逆轉錄酶的保守結構域DDE類似,這三個位點參與了幾乎所有的轉座活動,包括DNA切割、發(fā)夾結構形成和目的序列的插入。具體的整合過程如下圖所示:
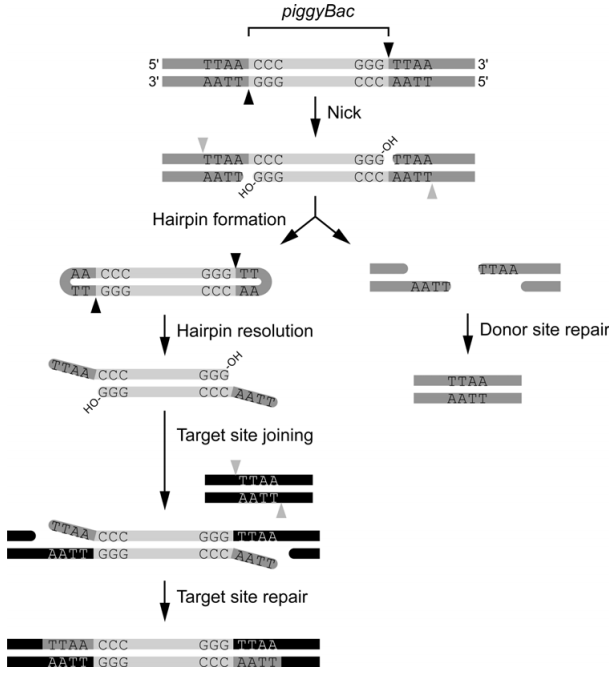
PiggyBac轉座酶結合到轉座子DNA序列兩端,開始精確地切割每條DNA鏈轉座子DNA的3’端,形成3’-OH結構;之后3’-OH攻擊互補鏈5’末端TTAA與轉座子間的磷酸二酯鍵,導致互補鏈DNA斷裂,釋放轉座子,同時轉座子兩端形成發(fā)夾結構;找到新的TTAA四堿基整合位點后,轉座酶伸展轉座子的發(fā)夾結構,暴露3’-OH,同時3’-OH攻擊TTAA整合位點的5’端,形成新的磷酸二酯鍵;互補鏈及轉座子釋放位點處的單鏈缺口的修復由宿主因子完成,轉座完成。
PiggyBac轉座子載體系統(tǒng)組成
PiggyBac轉座子在發(fā)現(xiàn)后經過了一系列優(yōu)化和改造的過程,如轉座酶密碼子優(yōu)化,以及兩端TIR序列的簡化,最后形成了一套完整的PiggyBac載體系統(tǒng)。PiggyBac載體系統(tǒng)成員主要有:一個輔助質粒:編碼轉座酶;一個轉座子質粒:含優(yōu)化的兩端亞末端反向重復序列,中間是被轉座區(qū)域,可插入我們想轉座到宿主基因組中的目的基因序列。
實驗時需同時將輔助質粒和轉座子質粒共同轉化靶細胞,輔助質粒編碼的轉座酶識別轉座子質粒兩端的TIR序列并切割,釋放的被轉座區(qū)被轉座酶整合到宿主基因組中含TTAA序列的位點,并在被轉座區(qū)兩端出現(xiàn)TTAA重復序列。
在不降低轉座效率的情況下,兩端優(yōu)化后的TIR序列間可插入10kb左右的序列,研究表明,在小鼠中通過受精卵注射的方式,用PiggyBac轉座子載體在基因組插入細菌人工染色體(BACs,150kb-300kb),轉座效率最高的達到了45%(F0代中有45%的小鼠攜帶了BACs)。
應用
1. 作為非病毒載體
與傳統(tǒng)的病毒載體相比,PiggyBac具有以下幾大優(yōu)點:首先是安全性高、操作方便(可直接用質粒轉化細胞);其次是載體容量大(10kb-20kb),可實現(xiàn)多基因的共表達;第三是可通過調節(jié)轉座子質粒和輔助質粒的比例,提高外源基因的整合效率,并且可通過反向PCR精確確定目的基因插入的位置;第四是再次轉座后實現(xiàn)精確切離;第五是轉座后不引起染色體重排等不穩(wěn)定現(xiàn)象;最后是宿主范圍廣,轉座效率高,較少依賴宿主因子。
2. 基因治療
研究表明,PiggyBac轉座系統(tǒng)在Hela、HEK293、CHO及H1299等細胞中高效轉座,且攜帶的目的基因穩(wěn)定表達,因而是很有吸引力的基因治療候選載體之一。
3. 突變工具
PiggyBac再次轉座偏向插入基因內部且插入位點分布較廣,可用作基因插入突變的工具,這點為哺乳動物的基因組功能研究提供了較好的研究工具。
賽業(yè)OriCell目前已應用PiggyBac與基于傳統(tǒng)CRISPR/Cas9研發(fā)而成的CRISPR-Pro技術結合實現(xiàn)大片段基因敲除,與移碼突變相比,敲除更徹底,各項實驗數(shù)據(jù)表明采用CRISPR-Pro技術更高效。相比于傳統(tǒng)病毒法構建的細胞株,使用PiggyBac構建的細胞株具有更高的遺傳穩(wěn)定性。賽業(yè)OriCell扎根基因敲除領域14年,擁有上萬例基因敲除項目經驗,平臺成熟穩(wěn)定,目前已成功敲除細胞株種類超過198種,成功保障,安全無憂。

關于OriCell®
OriCell®是賽業(yè)生物旗下致力于干細胞試劑及干細胞技術服務的子品牌,作為擁有14年歷史的科研干細胞供應商,OriCell®旗下?lián)碛幸?guī)模龐大、品種齊全的科研干細胞庫。自主開發(fā)了百余種干細胞及原代細胞產品,獨立起草的數(shù)十種科研干細胞標準更已成為國際主要參考的干細胞技術標準。OriCell®干細胞及相關培養(yǎng)基已服務數(shù)萬客戶,獲得了市場占有率和滿意度的雙贏。OriCell®提供的干細胞誘導分化服務、細胞基因編輯服務與穩(wěn)轉細胞株構建服務已幫數(shù)千名科研人員解決了科研難題,產品與技術已直接應用于包括CNS(Cell, Nature, Science)三大期刊在內的3600余篇學術論文。如有需要,歡迎聯(lián)系我們咨詢。





