中檢院CAR-T細胞治療產品質控文件《考慮要點》深度解析
2018年6月5日,中國食品藥品檢定研究院發布了《CAR-T細胞治療產品質量控制檢測研究及非臨床研究考慮要點》(以下簡稱《考慮要點》)。相信這一文件對所有CAR-T細胞治療的從業者都具有重要的指導意義。

《考慮要點》對CAR-T細胞研發和制備的以下幾個方面進行了深入的探討:
-原材料和輔料及其質量控制
-病毒轉導載體及質粒轉染載體制備及質量控制
-建立可提供T細胞的供體資質標準
-CAR-T細胞產品的生產、質量控制研究及檢測
在“CAR-T細胞產品的生產、質量控制研究及檢測”這一章節中,細胞數量及細胞存活率被列為CAR-T細胞產品質量控制的兩項重要的檢測指標:
“細胞數量及細胞存活率:對于CAR-T細胞來說,患者輸入的細胞數及活率不僅與臨床有效性及臨床副反應密切相關,而且是設置CAR-T細胞產品包裝規格及臨床劑量的重要參數,因此,需要建立準確的細胞計數及活率檢測方法,并建立產品的放行標準。
目前有多種方法用于CAR-T細胞治療產品的細胞計數,包括傳統血球計數板計數法及細胞自動計數儀計數法,其中自動計數儀又包括不同的計數原理,如利用臺盼藍染色計數、熒光染色法計數及非染色法計數等。與人工計數法相比,自動計數儀節省人工,且明顯減少不同操作者之間的誤差,對于產品質控檢測來說,自動計數儀檢測結果的可重復性更好。"
我們看到經過細胞計數儀開發者多年的市場推廣和用戶自身經驗的積累和傳播,自動細胞計數儀相對于人工計數法的優勢已被細胞研究者們廣泛接受以及得到了權威機構的認可。
《考慮要點》同時提到:“不同自動計數儀因每種方法計數原理不同,同一樣本在不同的計數儀上的結果會有明顯的差異,這些差異可能來自于染料的特性及其標記特性、區分細胞不同活力狀態(如活細胞、死亡、凋亡細胞)的能力及計數軟件的設計等,因此,應在計數方法驗證的基礎上建立細胞數及活率標準,且細胞數應設立上限及下限標準,細胞使用前活率應不低于70%...” 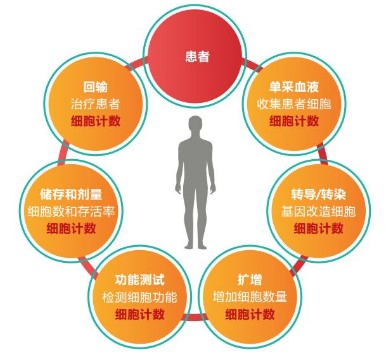 由此可見,在CAR-T細胞的生產和質控流程中,對細胞計數儀的選擇也是相當重要的。目前各品牌細胞計數儀的計數原理主要分為兩種:臺盼藍染色計數和熒光染色計數。眾所周知,在CAR-T細胞制備的前期需要從外周血單核細胞(PBMC)中分選出T細胞,因此PBMC的數量和存活率對于CAR-T的生產至關重要。現在小編就以分析PBMC為例介紹一下臺盼藍染色和以AO/PI(吖啶橙/碘化丙叮)為代表的熒光核酸染色的差異【1】:
由此可見,在CAR-T細胞的生產和質控流程中,對細胞計數儀的選擇也是相當重要的。目前各品牌細胞計數儀的計數原理主要分為兩種:臺盼藍染色計數和熒光染色計數。眾所周知,在CAR-T細胞制備的前期需要從外周血單核細胞(PBMC)中分選出T細胞,因此PBMC的數量和存活率對于CAR-T的生產至關重要。現在小編就以分析PBMC為例介紹一下臺盼藍染色和以AO/PI(吖啶橙/碘化丙叮)為代表的熒光核酸染色的差異【1】:
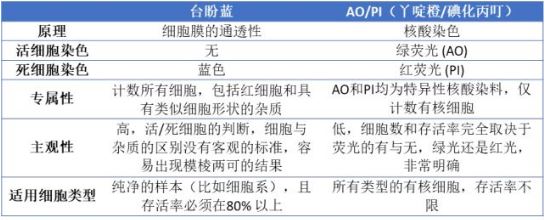
以上列出的差異都是從大量實際操作中總結出來的。用臺盼藍數PBMC, 細胞總數往往會高于實際白細胞數,有時甚至可以達到10倍以上【2】!另外,由于臺盼藍容易低估死細胞數,用這種方法測出的存活率也會比實際值高,在某些情況下甚至會高出30%以上!如果我們用這樣的檢測結果去進行CAR-T細胞的制備,其后果可想而知。
熒光核酸染色是目前公認的最可靠的細胞計數方法之一
十多年前,斯坦福大學的Leonore A. Herzenberg實驗室用AO和EB的混合液對細胞染色,然后在熒光顯微鏡下計數,發現了該方法相對于臺盼藍法的優越之處,尤其是數混雜的細胞樣本比如PBMC。 之后,美國Nexcelom公司在此基礎之上于2008年開發出了AO/PI混合染料,并將熒光計數功能添加到了Cellometer細胞計數儀,使很多實驗室能夠輕松地用這種更精確的方法分析細胞。2013年,Cellometer的用戶之一國立衛生研究院疫苗研究中心的Roederer實驗室將雙熒光染色法分析T細胞的方法發表在了Nature Protocols【3】上,使得這一方法為更多科學家所知。
如今,AO/PI染色法和Cellometer熒光細胞計數儀正在被越來越多的研究機構和企業用于CAR-T細胞的研發、生產和質控。我們的用戶包括了世界最頂尖的制藥公司、大學、研究所和生物技術企業。我們相信,國家對CAR-T細胞治療產品質量的控制和管理會越來越規范和嚴格,這也意味著在CAR-T細胞開發的每一個環節我們都需要有工匠精神,精益求精。Nexcelom會一如既往地致力于細胞分析方法的創新和開發,為推進中國的細胞治療產業化貢獻應有的力量
文獻索引
1. Chan L L, Kuksin D, Laverty D J, et al. Morphological observation and analysis using automated image cytometry for the comparison of trypan blue and fluorescence-based viability detection method.[J]. Cytotechnology, 2015, 67(3):461-73.
2. Chan L L, Laverty D J, Smith T, et al. Accurate measurement of peripheral blood mononuclear cell concentration using image cytometry to eliminate RBC-induced counting error[J]. Journal of Immunological Methods, 2013, 388(1-2):25-32.
3. Lugli E, Gattinoni L, Roberto A, et al. Identification, isolation and in vitro expansion of human and nonhuman primate T stem cell memory cells.[J]. Nature Protocols, 2013, 8(1):33-42.

《考慮要點》對CAR-T細胞研發和制備的以下幾個方面進行了深入的探討:
-原材料和輔料及其質量控制
-病毒轉導載體及質粒轉染載體制備及質量控制
-建立可提供T細胞的供體資質標準
-CAR-T細胞產品的生產、質量控制研究及檢測
在“CAR-T細胞產品的生產、質量控制研究及檢測”這一章節中,細胞數量及細胞存活率被列為CAR-T細胞產品質量控制的兩項重要的檢測指標:
“細胞數量及細胞存活率:對于CAR-T細胞來說,患者輸入的細胞數及活率不僅與臨床有效性及臨床副反應密切相關,而且是設置CAR-T細胞產品包裝規格及臨床劑量的重要參數,因此,需要建立準確的細胞計數及活率檢測方法,并建立產品的放行標準。
目前有多種方法用于CAR-T細胞治療產品的細胞計數,包括傳統血球計數板計數法及細胞自動計數儀計數法,其中自動計數儀又包括不同的計數原理,如利用臺盼藍染色計數、熒光染色法計數及非染色法計數等。與人工計數法相比,自動計數儀節省人工,且明顯減少不同操作者之間的誤差,對于產品質控檢測來說,自動計數儀檢測結果的可重復性更好。"
我們看到經過細胞計數儀開發者多年的市場推廣和用戶自身經驗的積累和傳播,自動細胞計數儀相對于人工計數法的優勢已被細胞研究者們廣泛接受以及得到了權威機構的認可。
《考慮要點》同時提到:“不同自動計數儀因每種方法計數原理不同,同一樣本在不同的計數儀上的結果會有明顯的差異,這些差異可能來自于染料的特性及其標記特性、區分細胞不同活力狀態(如活細胞、死亡、凋亡細胞)的能力及計數軟件的設計等,因此,應在計數方法驗證的基礎上建立細胞數及活率標準,且細胞數應設立上限及下限標準,細胞使用前活率應不低于70%...”

以上列出的差異都是從大量實際操作中總結出來的。用臺盼藍數PBMC, 細胞總數往往會高于實際白細胞數,有時甚至可以達到10倍以上【2】!另外,由于臺盼藍容易低估死細胞數,用這種方法測出的存活率也會比實際值高,在某些情況下甚至會高出30%以上!如果我們用這樣的檢測結果去進行CAR-T細胞的制備,其后果可想而知。
熒光核酸染色是目前公認的最可靠的細胞計數方法之一
十多年前,斯坦福大學的Leonore A. Herzenberg實驗室用AO和EB的混合液對細胞染色,然后在熒光顯微鏡下計數,發現了該方法相對于臺盼藍法的優越之處,尤其是數混雜的細胞樣本比如PBMC。 之后,美國Nexcelom公司在此基礎之上于2008年開發出了AO/PI混合染料,并將熒光計數功能添加到了Cellometer細胞計數儀,使很多實驗室能夠輕松地用這種更精確的方法分析細胞。2013年,Cellometer的用戶之一國立衛生研究院疫苗研究中心的Roederer實驗室將雙熒光染色法分析T細胞的方法發表在了Nature Protocols【3】上,使得這一方法為更多科學家所知。
如今,AO/PI染色法和Cellometer熒光細胞計數儀正在被越來越多的研究機構和企業用于CAR-T細胞的研發、生產和質控。我們的用戶包括了世界最頂尖的制藥公司、大學、研究所和生物技術企業。我們相信,國家對CAR-T細胞治療產品質量的控制和管理會越來越規范和嚴格,這也意味著在CAR-T細胞開發的每一個環節我們都需要有工匠精神,精益求精。Nexcelom會一如既往地致力于細胞分析方法的創新和開發,為推進中國的細胞治療產業化貢獻應有的力量
文獻索引
1. Chan L L, Kuksin D, Laverty D J, et al. Morphological observation and analysis using automated image cytometry for the comparison of trypan blue and fluorescence-based viability detection method.[J]. Cytotechnology, 2015, 67(3):461-73.
2. Chan L L, Laverty D J, Smith T, et al. Accurate measurement of peripheral blood mononuclear cell concentration using image cytometry to eliminate RBC-induced counting error[J]. Journal of Immunological Methods, 2013, 388(1-2):25-32.
3. Lugli E, Gattinoni L, Roberto A, et al. Identification, isolation and in vitro expansion of human and nonhuman primate T stem cell memory cells.[J]. Nature Protocols, 2013, 8(1):33-42.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





