機體抗病毒免疫的作用原理
前言
病毒是專性的細胞內寄生,需要在宿主內復制,并促進它們傳播到其他地方。在人類中,大多數臨床相關感染來自其他動物,這一過程仍在繼續。最近的例子包括人類免疫缺陷病毒(HIV)、埃博拉病毒、SARS病毒,ZIKA病毒,新型冠狀病毒等。
病毒感染很少是直接致命的,即使它們對單個細胞具有高度的細胞溶解性。
死亡率通常發生在病毒物種間跳躍、病毒經歷重大抗原變化(即流感病毒)或宿主免疫受損時。
病毒進入及感染
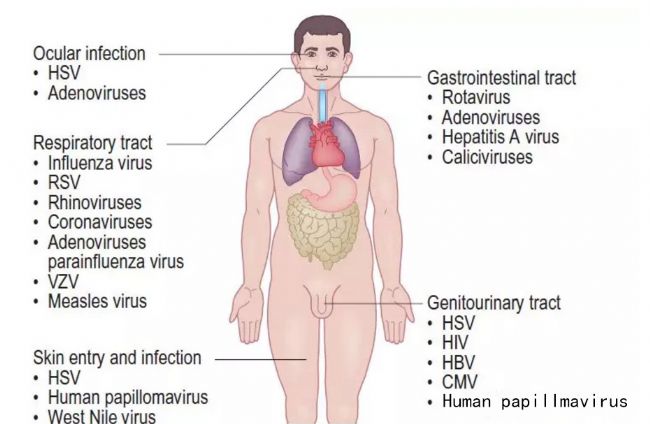
機體組織產生大多數病毒的進入和感染的障礙。其中最有效的是皮膚和粘膜表面提供的機械屏障,以及腸道的化學敵對環境 。
許多常見的人類病毒病原體通過胃腸道進入,包括輪狀病毒、腸腺病毒和甲型肝炎病毒(HAV)。這些通常是通過人與人的接觸或受污染的食物和水傳播的。
由流感病毒、鼻病毒、冠狀病毒、麻疹病毒、水痘-帶狀皰疹病毒(VZV)和呼吸道合胞病毒(RSV)引起的呼吸道感染通常通過氣溶膠飛沫傳播,以及人與人之間的接觸傳播。
許多皰疹病毒針對皮膚或粘膜,如單純皰疹病毒(HSV)和VZV。尤其是HSV,可以通過小的割傷和擦傷感染口腔和生殖器粘膜、眼睛和皮膚。其他皰疹病毒,如Epstein-Barr病毒(EBV)和巨細胞病毒(CMV),以粘膜為靶點。CMV也可以從母親垂直傳播到嬰兒,很少通過輸血。人乳頭瘤病毒(HPV)針對皮膚和粘膜,導致疣,并可能轉化細胞,誘發癌癥,如宮頸癌。
一些病毒,如西尼羅病毒、登革熱病毒、半林病毒和齊卡病毒,可以通過昆蟲媒介進入皮膚。
艾滋病毒和乙型肝炎病毒(HBV)通常通過性接觸傳播。艾滋病毒、HBV和丙型肝炎病毒(HCV)也可以通過輸血或受污染的針頭直接進入血液傳染給人類。
大多數人類病毒只在某些靶組織中復制,主要由病毒受體分布的決定。許多病毒使用兩種受體,如CD4共受體和趨化因子受體CCR5在HIVT細胞上的表達。
在附著到細胞受體后,病毒可能與細胞膜融合或內吞,然后通過與囊泡膜(包膜病毒,如HSV和HIV)融合進入細胞質或細胞核,或在細胞質中一次跨細胞膜或誘導內吞囊泡裂解(無核病毒,如Norwalk病毒和脊髓灰質炎病毒)。
然后,病毒利用宿主細胞機制和專門的病毒編碼蛋白在細胞內快速復制。一旦它們在細胞內繁殖,許多病毒就會誘導細胞溶解,以促進新的傳染性病毒(例如,痘病毒、脊髓灰質炎病毒和皰疹病毒)的釋放。
在細胞不死亡的情況下,其他病毒通過細胞膜從受感染的細胞中釋放出來(例如艾滋病毒和流感病毒)。然而,病毒進入人體后,會遇到許多先天防御,并激活適應性免疫。
通過疫苗,成功利用這些防御手段,仍然是戰勝許多病毒感傳染疾病的核心方法,特別是那些導致慢性感染的病毒,如HIV和HCV.
天然免疫
病毒感染引起宿主廣泛的防御機制,先天防御可以阻止或抑制初期感染,保護細胞免受感染,或消滅病毒感染的細胞。
先天機制早在適應性免疫的效應變得活躍之前就已出現,但它們對于通過激發促進免疫細胞活化的炎癥,來啟動適應性免疫是至關重要的。
先天免疫防御是通過模式識別受體(PRRS)啟動的,它識別病原體相關分子模式(PAMP),包括Toll樣受體(TLR)家族的跨膜受體、兩個細胞內受體家族(NOD樣受體(NLRs)和RIG-I樣解旋酶(RLHs)),以及黑色素瘤-2(AIM2)中缺失的傳感器分子。
此外,環鳥苷一磷酸-腺苷一磷酸合成酶cGAS、DDX41、IFI16和z-DNA結合蛋白1(ZBP1)分子可以感知細胞質DNA。
這些細胞傳感器促進IL-1,IL-18、I型(α/β)-IFN)、干擾基因和炎癥細胞因子及趨化因子的表達。TLRs是由許多細胞表達的細胞表面或內小體膜結合蛋白,包括樹突狀細胞(DCS)、巨噬細胞、淋巴細胞和實質細胞。
在大多數細胞類型中,TLRs的表達在很大程度上是可誘導的,一些(TLR7/8/9)在專門的漿細胞樣DCS高水平上表達,以快速產生IFN。
不同的TLR分子識別特定的病毒產物,如單鏈和雙鏈RNA(TLR3和TLR7/8)或雙鏈DNA(TLR9),如下圖:

NLRPs是PAMPS的第二類胞漿傳感器,通過適配器蛋白ASC激活炎癥小體。這些包括NLR P(或NALP)、NOD和IPAF/NAIP受體。有三種主要的炎癥體參與了抗病毒免疫:NLRP3炎癥體、RIG-I炎癥體和AIM2炎癥體。先天防御系統由多種細胞成分和許多特殊蛋白質組成。已知和研究得最多的抗病毒蛋白是α/βIFNs,他們通過I型IFN受體發揮作用,并引起100多種基因變化。這種“抗病毒狀態”的后果之一是抑制細胞蛋白質合成和防止病毒復制。
多個白細胞亞群參與先天防御,包括巨噬細胞、DCS、中性粒細胞、自然殺傷細胞(NK)、自然殺傷T細胞(NKT細胞)和γδT細胞。此外,組織細胞,包括成纖維細胞、上皮細胞和內皮細胞,通過產生先天細胞因子,包括IFN-I和IL-1,表達PRRS并對病毒感染作出反應。INF-I是先天免疫系統和適應性免疫系統之間的關鍵聯系通過激活DCS和T細胞,以及保護T細胞免受NK細胞介導的攻擊。干擾素-I還能激活NK細胞并誘導其他促進NK反應的細胞因子,如IFN-γ和IL-12。NK細胞產生促炎細胞因子,可以殺死感染細胞并與DCS相互作用,是抵御病毒的重要組成部分。
NK細胞對小鼠和人類CMV的抗性很重要,可能對HIV、流感病毒和埃博拉病毒也很重要 。通過殺死CD4T細胞和間接調節細胞毒性T淋巴細胞(CT L)反應,NK細胞也可以控制對病毒適應性免疫反應。NKT細胞可能對某些病毒,如流感病毒,提供一些抗原特異性的天然免疫保護。
幾類天然宿主蛋白在抗病毒防御中起作用。其中包括天然抗體,這種抗體可能在防御某些病毒感染方面起作用,還包括pentraxins和補體蛋白。有些病毒可能被激活補體直接滅活,或被結合和吞噬了補體結合病毒的吞噬細胞破壞。病毒感染誘導的幾種促炎細胞因子和趨化因子在防御中也起著關鍵作用。其中最主要的是IL-1和IL-1家族的其他成員,包括IL-18和IL-33。
這些細胞因子影響先天和適應性免疫細胞,并在抗病毒防御中發揮關鍵作用。其他抗病毒細胞因子在感染后早期產生,如TNF-α、IFN-γ、IL-12、IL-6和趨化因子,如MIP-1α。
特別是,IL-12是NK細胞中IFN-γ的有效誘導劑.炎癥趨化因子也可能通過在感染部位協調巨噬細胞、中性粒細胞、DC和NK細胞的反應,在先天抗病毒防御中發揮重要作用。
不僅先天免疫的這些成分參與了對病毒的初步保護;幾個成分(例如PPRs;細胞因子IFN-I、IL-1、IL-33和IL-12;以及吞噬細胞,包括巨噬細胞、單核細胞和DCs)有助于塑造隨后對病毒病原體的適應性反應的性質和有效性。
例如,DCS需要先天信號,如IFN-I和IL-12,才能成熟和產生最佳的T細胞激活.此外,響應病毒的CD8T細胞需要IFN-I和IL-33信號來擴展和形成記憶。
病毒感染引起的先天反應的大小和類型都對適應性免疫反應的產生有著明顯的影響。

先天免疫通常只會減緩而不是停止病毒感染,給適應性免疫反應創造時間。
適應性免疫的兩個主要部分,抗體介導和T細胞介導,主要針對不同的靶點.
抗體通常通過與游離的病毒顆粒結合而發揮作用,阻斷宿主細胞的感染 。
相反,T細胞的作用主要是識別和破壞病毒感染的細胞,或啟動炎癥反應。由于所有病毒都在細胞內復制,而且許多病毒可以在細胞間直接傳播,而不會重新進入細胞外環境,因此感染的解決更多地依賴于T細胞功能而不是抗體功能 。然而,廣泛中和抗病毒抗體具有有效治療許多不同人類感染的潛力,包括HIV、流感病毒和埃博拉病毒。
最近的進展使研究人員能夠分離和鑒定人類針對這些病原體和其他病原體的單克隆抗體,為新療法提供了前景,并為疫苗設計提供了重要的見解.抗病毒抗體作為抗再感染的免疫保護屏障也是非常重要的。主要是入口處(通常是粘膜表面)有抗體,這與流感、HSV和艾滋病毒感染特別相關.然而,如何產生能引起最佳抗體反應的疫苗,包括廣泛的中和抗體,仍然是一個尚未解決的重要問題。
適應性免疫的啟動密切依賴于激活抗原提呈細胞(APC)的早期先天機制,主要是DCs。通過趨化因子和細胞因子信號將APC和淋巴細胞吸引到淋巴組織中,并在那里保留幾天,以促進有效的細胞間相互作用。
次級淋巴組織的結構通過支持性基質細胞網絡和局部趨化因子梯度支持適應性免疫系統細胞之間的協調相互作用。
誘導事件發生在淋巴結引流感染部位或脾臟,如果病毒進入血液。病毒抗原傳遞到淋巴結通常發生在DCS中。有些病毒會損害APC的功能,如HSV和麻疹病毒,從而抑制DC的成熟。
在脾臟和淋巴結,B細胞濾泡,T細胞區,B細胞遇到抗原后激活。一些活化的B細胞成為短壽命的漿細胞,而另一些則移動到B細胞卵泡的邊緣,并通過在B細胞MHCII類分子上呈遞抗原肽與抗原特異性輔助CD4T細胞相互作用。
這些BCL6依賴的CD4T濾泡助劑(Tfh)細胞是專門為B細胞反應提供幫助的細胞,是促進和調節B細胞反應所必需的。
活化的B細胞在CD4Tfh細胞的幫助下啟動生發中心(GC)反應,確保體細胞的高突變和親和力成熟,以選擇高親和力、產生抗體、長壽命的漿細胞以及記憶B細胞。
在分子水平上,轉錄因子Blimp-1、XBP-1和IRF-4的上調決定了漿細胞的形成,而Pax-5的表達則描述了注定要進行GC反應的B細胞和記憶B細胞譜系。
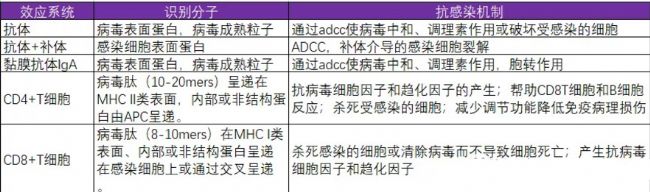
抗體結合表達在天然蛋白質表面的表位,阻止病毒附著或滲透到目標細胞。之后通過CDC或者ADCC的作用,裂解病毒。偶爾,抗體結合病毒的FC受體結合可能導致感染,并導致更嚴重的組織損傷,發生在登革熱和HIV感染。參與保護人體粘膜表面的抗體主要是分泌性免疫球蛋白A(IgA),但血清衍生的IgG也可能具有保護作用,特別是在陰道粘膜等部位 。
這兩種抗體同型主要作用于阻斷上皮細胞的感染,盡管在某些情況下,抗體可以將抗原從體內通過上皮細胞轉運到體外 。
與血清抗體相比,粘膜抗體的持續時間要短得多,這在一定程度上解釋了為什么對粘膜病原體的免疫通常比對全身病毒感染的免疫時間短得多。
總結抗感染免疫如下表
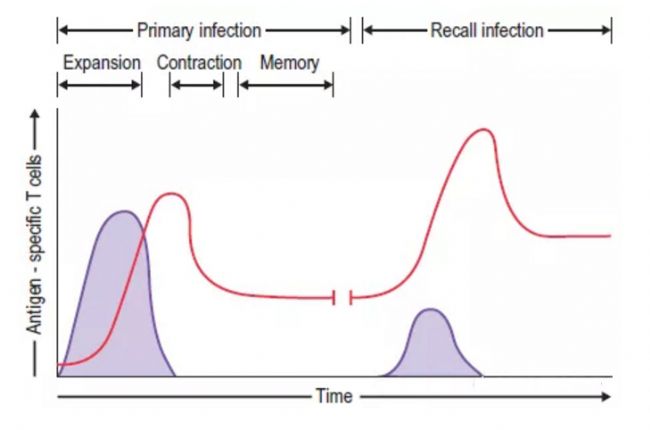
免疫記憶是適應性免疫的主要特征。疫苗學的目的是誘導長期免疫記憶,以防止再感染 。在感染某些病毒后,記憶可能會異常長壽,可能對宿主的生命有影響(黃熱病和天花病毒 )。
記憶的定義是特異性淋巴細胞和產生抗體的漿細胞的持續存在,而不是抗原的持續存在,以誘導淋巴細胞的持續激活。
對病毒的體液記憶涉及骨髓中的長壽命漿細胞,這提供了一個持續的低水平血清抗體來源。體液免疫的維持也涉及一群穩態維持記憶B細胞,這可能是維持穩定數量的長壽命漿細胞所必需的。記憶T細胞池由細胞因子IL-7和IL-15控制的低水平穩態分裂調節。對于記憶體CD8T細胞來說,IL-7對于存活是至關重要的,而IL-15對于維持記憶體T細胞池大小的低水平增殖是至關重要的。
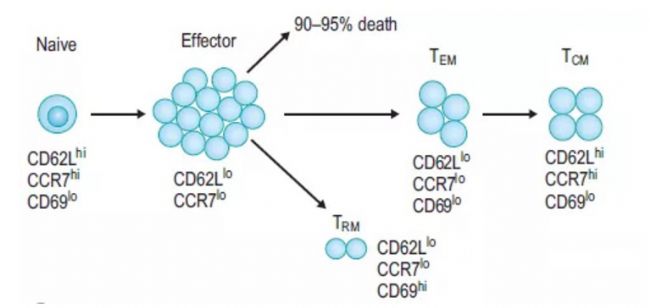
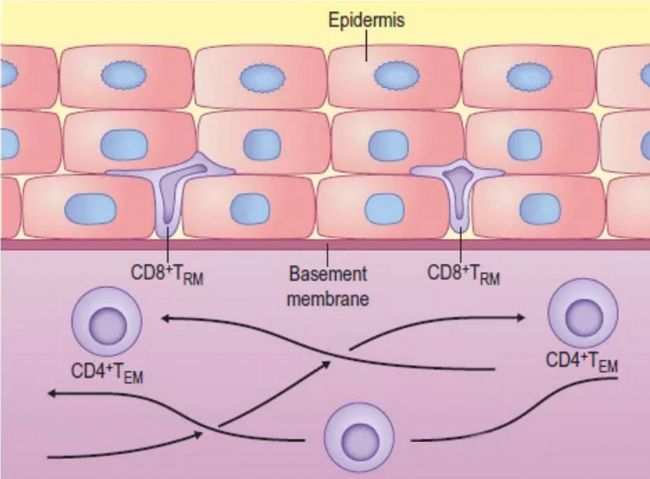
效應和記憶T細胞分化。抗原刺激擴大效應細胞,其中大多數在收縮期死亡。隨著時間的推移,形成的效應記憶T(TEM)細胞逐漸轉化為中央記憶T(TCM)細胞,表面標記表達發生相應的變化。一些效應T細胞發展為駐留記憶T(TRM)細胞,這些細胞持續存在于組織中,不再進入循環。
病毒免疫逃避的機制
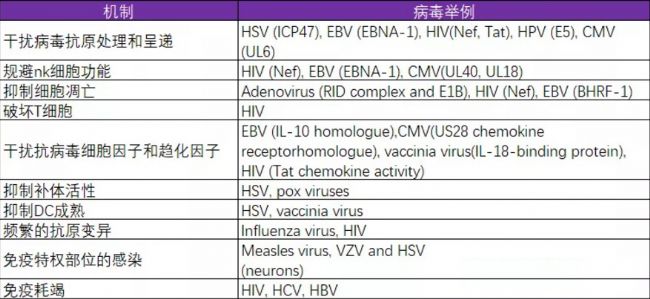
許多病毒,采用減弱免疫或延遲的策略來規避免疫系統的各種防御機制,使它們有時間進一步復制或逃避監測。
具體機制及實例見下表
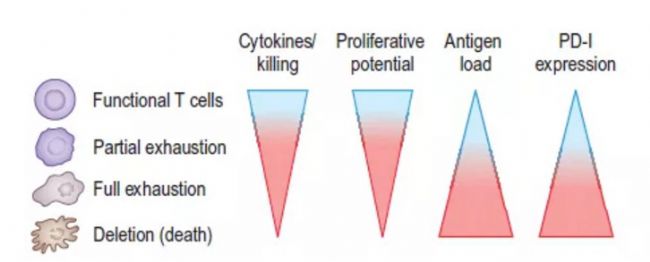
評:
SARS,H7N9,H5N1, 2019-nCov, MERs......病毒肆虐,不斷給人類提醒,寫點基礎的東西,供大家這兩天在家無聊時看看。
疫苗開發,可以參考之前文章:反向疫苗學2.0升級版:基于抗原結構的疫苗設計及案例。
新型冠狀病毒防治請閱讀國家官方指南。
參考文獻
-
Kanneganti TD. Central roles of NLRs and inflammasomes in viral infection. Nat Rev Immunol 2010;10:688–98.
-
Wherry EJ, Kurachi M. Molecular and cellular insights into T cell exhaustion. Nat Rev Immunol 2015;15:486–99.
-
Mueller SN, Gebhardt T, Carbone FR, et al. Memory T cell subsets, migration patterns, and tissue residence. Annu Rev Immunol 2013;31:137–61.
-
Barry T. Rouse, Scott N. Mueller,Host Defenses to Viruses,Clinical immunology,Book • 5th Edition • 2019





