基因治療又現曙光,關于地貧你知多少
12月7日-10日,一年一度的美國血液學會(ASH)如期而至,盛會上來自全世界的血液學工作者發表著最新進展。如拜耳公布了其AAV基因療法在A型血友病的1/2期臨床試驗中取得積極數據,Sangamo公布針對β地貧的1/2期臨床最新數據,這是繼CRISPR Therapeutics和Vertex Pharmaceuticals宣布其CTX001在臨床1/2期試驗對輸血依賴性β地中海貧血癥(TDT)和嚴重鐮狀細胞貧血癥(SCD)中的有效治療數據后的,基因治療在遺傳類血液疾病中又一捷報。同時今年6月,Bluebird bio公司也宣布其基因療法Zynteglo被歐盟批準上市治療β地貧。越來越多的科研團隊加入基因治療地貧的研發隊伍,既讓我們看到基因療法治愈遺傳疾病的潛能,同時也慶幸這類真正“缺醫少藥”的罕見疾病逐漸受到社會廣泛關注。所以,本期我們就與大家一起走進這類不被大眾熟悉的疾病—地中海貧血,重點關注其在國內的情況。
一、什么是遺傳性血液病
遺傳性血液病(hereditary blood diseases)是指遺傳因素引起的血液系統造血功能紊亂的疾病,主要包括遺傳性紅細胞系統疾病,遺傳性白細胞系統疾病以及遺傳性出血疾病幾大類。其代表性疾病主要有地中海貧血(Thalassemia,簡稱地貧),鐮刀形紅細胞貧血癥(Sickle Cell Disease, SCD)血小板無力癥(Glanzmann thrombasthenia),血友病(Hemophilia)等[1]。其中地貧和SCD均屬于基因突變使血紅蛋白缺陷而導致的遺傳性紅細胞系統疾病,故常可以用于基因療法根治!如CTX001采用CRISPR/Cas9技術編輯病人自體CD34+造血干細胞后回輸病人體內,從而源源不斷的產生正常血紅蛋白以達到治療甚至治愈地貧和SCD的效果。
二、地貧和鐮狀細胞貧血癥屬于罕見病嗎?
1. 地貧和鐮狀細胞貧血癥的發病現狀
地貧和鐮狀細胞貧血癥屬于罕見病的說法似乎已經被廣泛傳播,不過這種說法還有待考量。先看一組數據:1925年,國際上Cooley和Lee 首先描述地中海貧血;我國于1940年首次報道廣州3名地貧患者,而后陸續發現于北京,浙江等地區,20世紀中期,一次覆蓋全國20個省市(自治區)的90萬人大規模血紅蛋白病調查,基本闡明了中國長江以南是地貧高發區,尤以廣西,廣東和海南三省(區)為甚[2,3]。
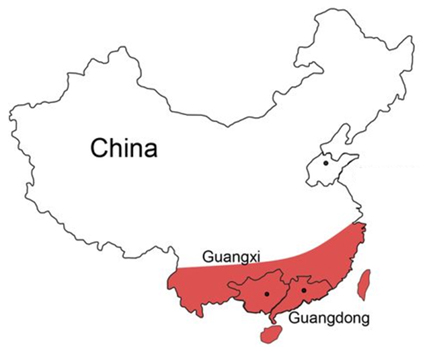
圖1:我國地貧主要分布區域[2]
據《中國地中海貧血防治藍皮書(2015)》的數據顯示,目前我國“地貧”基因攜帶者約3000萬人,涉及近3000萬家庭一億人口,其中重型和中間型“地貧”患者約30萬人且正以每年約10%的速度遞增[3]。
地貧主要分布在包括中國南方在內的全球瘧疾高發的熱帶和亞熱帶地區,我國長江以南廣大地域是地中海貧血的高發區,尤其以廣西、廣東和海南三省為甚。其中廣西地貧發病率最高,人群中每4~5人就有1個地貧缺陷基因攜帶者,每55個家庭就有1個有重型地貧出生風險,如果沒有嚴格的防控措施,每出生200~250個胎兒就有1個重型地貧患兒;其次是廣東,地貧基因攜帶者大于10%,以2019年人口數1.13億人計算,地貧基因攜帶者超過1000萬人[3]。
2. 如何定義罕見病?
回到開始的問題上,關于罕見病的定義,是指發病率很低、很少見的疾病,一般為慢性、嚴重的疾病。但不同國家定義不同:

表1. 不同國家對于罕見病的定義[4]
由上表看到,不同國家對于罕見病定義依國情而不同,但在中國,罕見病一直沒有明確的法律釋義。2010年5 月,中華醫學會醫學遺傳學分會在上海舉辦的中國罕見病定義專家研討會上,與會專家建議將中國的罕見病定義為患病率小于1/500,000或新生兒發病率小于1/10,000 的疾病。據此估算,中國罕見病患者人數約為1,680萬。如果按照30萬的發病人數計算,地貧剛好大于這個發病率。
3. 地貧可能并不屬于罕見病,而鐮狀細胞貧血癥卻在列!
2018年5月,國家衛生健康委員會、科學技術部、工業和信息化部、國家藥品監督管理局、國家中醫藥管理局五部門聯合公布《第一批罕見病目錄》,收錄了121種罕見病。這是中國政府首次以疾病目錄的形式界定何為罕見病。在這個列表里,我們并沒有看到地貧,不過鐮狀細胞貧血癥卻在列。因為在我國,鐮狀細胞貧血癥發病率很低,主要集中在黑色人種,如在非洲黑人中的發病率最高,在意大利,希臘等地中海沿岸國家和印度等地,發病人數也不少,目前主要在我國南方發現這類案例。所以地貧是否屬于罕見病一直沒有明確說法。至少目前數據看來,地貧儼然已成為西南地區的常見病,因此嚴格防控以及治療措施的重要性不言而明[5]!
三、地貧的致病機理
地貧最早發現于地中海人群,故稱為地中海貧血,又稱海洋性貧血或珠蛋白生成障礙性貧血,由于珠蛋白基因表達異常而無法形成正常功能的血紅蛋白而引發,是一種常染色體陰性遺傳病,是最早在分子水平上闡述其病理學機制的人類遺傳病之一。具體致病機理[6]如下:
如下圖所示,人體正常血紅蛋白結構有2條α-珠蛋白和2條β-珠蛋白分別攜帶一個血紅素后聚合形成血紅蛋白(hemoglobin,Hb)四聚體,承擔人體內氧運輸任務,當α-珠蛋白與β-珠蛋白比例(正常比例為α:β=1)失衡,地貧發病。
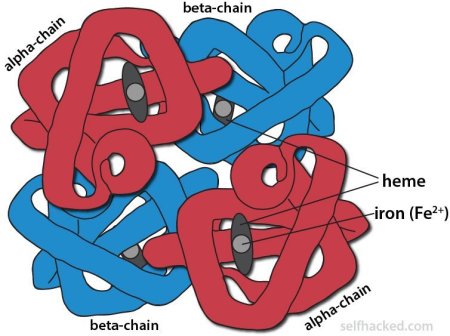
圖2. 人類正常珠蛋白基因示意圖
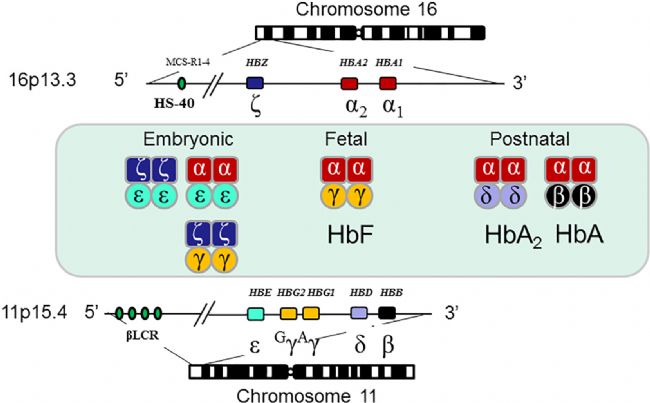
圖3. 人類α-和β-珠蛋白基因定位與結構[6]
【注】:α-珠蛋白基因位于16號染色體16p13.3位點,本基因簇含有胚胎期表達基因(ζ)一個,胎兒與成人期表達基因(α1和α2)2個,假基因(ψζ,ψα1)2個,疑似珠蛋白假基因(ψα2,θ)2個,以上α族基因的表達受控于重要調控位點HS-40。同理β-珠蛋白基因簇位于11號染色體11p15.3位點,排列有胚胎期表達基因(ε)1個,胎兒期表達基因( Gγ,αγ)2個,成人期表達基因(β和δ)2個,假基因(ψβ)1個,以上β族基因表達受控于座位調控區(LCR, locus control region)[6]。
1. 地貧的種類
根據異常表達基因的不同,可分為α-地貧,β-地貧,δ-地貧,γ-地貧,δγ-地貧,εγδβ-地貧,其中α-和β-地貧較為常見。此外依據病情輕重不同,β-地貧又分為重型,中型和輕型,α-地貧又分為靜止型,輕型,中間型和重型。具體如下表所示
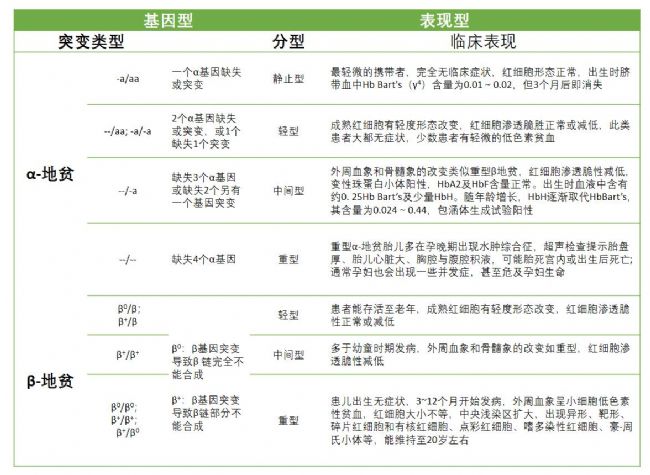
表2. 根據基因型對地貧進行分類及其表現型[6]
2. 地貧的主要突變形式
α-和β-地貧較為常見,下面主要看這2種地貧的突變形式。α-地貧:主要由基因缺失引起的,如下表(-α3.7/)和(-α4.2/)是中國人最常見的α+-地貧(α-基因功能部分保留記為α+,功能完全喪失記為α0);除了基因缺失,也有少部分是由基因點突變引起的,目前在中國已報道了12種非缺失型α-地貧,其中αWSα/(Hb Westmead,靜止型α-地貧)最為常見。
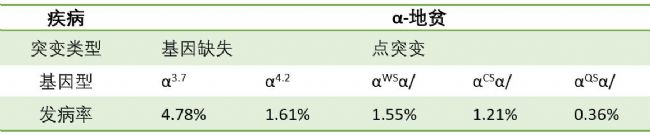
表3. α-地貧主要不同突變形式的占比
β-地貧:主要由基因點突變引起,全世界發現200多種,中國已報道48種。其中常見突變有6種,CD41-42(-TCTT缺失),約占45%,其次是IVS-II654,CD17(A到T點突變),TATA盒子-28等。如下表所示
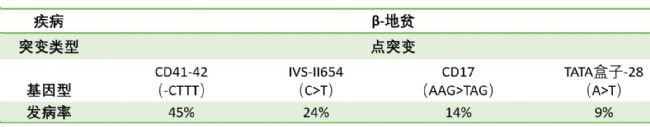
表4. β-地貧主要不同突變形式的占比[6]
四、地貧治療有方?
目前臨床上針對地貧的處置方法有輸血,鐵螯合劑治療,脾臟切除等等[6](為什么用“處置”而非“治療”?那是因為以上方法僅僅是起到緩解與維持作用且存在嚴重副作用或局限性,并不能治愈)。
- 輸血:輸血療法為目前地貧主要處置措施,目的在于維持正常血紅蛋白水平,預防慢性供氧不足等以及代償性骨髓增生等并發癥,此外為了避免輸血反應,輸入的是洗滌紅細胞,即少白細胞的紅細胞,但反復輸血使體內鐵負荷增加,存在嚴重副作用,即含鐵血黃素沉著癥,必須同時接受去鐵治療;
- 除鐵治療:如上所述,機體鐵負荷增加,紅系細胞造血過剩,腸道鐵吸收也會增加,機體排鐵障礙,若不及時去鐵,會引起發育停滯,肝硬化,糖尿病,心功能衰竭等,但去鐵治療同樣存在嚴重不良反應。常用鐵螯合劑包括得斯芬(Desferrioxamine,去鐵胺甲磺酸鹽注射劑;不良反應有致白內障,長骨發育障礙等),奧貝安可(Deferiprone,L1,去鐵酮片;不良反應有關節痛,腸道反應和鋅缺乏等),恩瑞格(Deferasirox,Exjade,地拉羅司分散片;不良反應有胃腸道反應,皮疹,聽覺減退等);
- 脾臟切除:對于經輸血及規范的去鐵治療而鐵負荷仍然增加的患兒考慮脾臟切除,但脾臟切除會增加嚴重敗血癥發生的風險,且脾切除對重型β-地貧治療效果仍然差;
-
造血干細胞移植(hematopoietic stemcell transplantation, HSCT):此法是目前唯一能根治重型β-地貧的方法。以人類白細胞抗原(HLA)配型選擇供體,方式有骨髓移植,外周血干細胞移植,臍血移植,但因合適的供體來源有限且價格昂貴平均醫療費用40萬元左右,臨床上難以開展,且影響成功率的因素繁多,不僅與配型有關,還需患者狀態即已接受的治療有關。此外移植并發癥如移植物抗宿主病(GVHD),肝靜脈阻塞病(hepatic vein occlusive disease,HVOD,簡稱VOD)、感染、出血和移植失敗均增加了此方法的普及難度。
基因治療--地貧患者的希望!
近日,基因療法在遺傳類血液疾病中頻傳捷報,讓我們看到了基因治療治愈地貧的希望。目前,針對地中海貧血的基因治療策略主要分為兩種,基于慢病毒整合的方式和基于基因編輯的方式。策略為:遞送功能性β-血紅蛋白基因拷貝或基因編輯組分至患者的造血干細胞(HSC),從此代替或輔助糾正病變的β-血紅蛋白基因完成工作。最新進展[7]如下:CRISPR Therapeutics和Vertex Pharmaceuticals:其資助的編號為NCT03655678的A Safety and Efficacy Study Evaluating CTX001 in Subjects With Transfusion-Dependent Thalassemia項目,在正在進行的1/2期臨床試驗中取得積極中期數據, 一名輸血依賴性β-地貧患者和一名嚴重鐮狀細胞貧血癥患者在接受CTX001治療后,均達到停止依賴輸血的效果。
這是在美國進行的首個評估CRISPR基因編輯療法的人體臨床試驗;Editas公司兩項臨床前實驗項目:于2019年10月7日發布消息,與Cas9對比更加優化的Cas12a-RNP介導編輯CD34+自體干細胞基因編輯獲得可喜進展,有望用于SCD治療。此外于16年發布CRISPR/Cas9用于CD34+自體干細胞基因編輯治療地中海貧血;MemorialSloan Kettering Cancer Center資助的編號為NCT01639690的ß-ThalassemiaMajor With Autologous CD34+ Hematopoietic Progenitor CellsTransduced With TNS9.3.55 a Lentiviral Vector Encoding the Normal Humanß-Globin Gene項目,基于慢病毒載體TNS9.3.55再編輯CD34+細胞,目前已進入1期試驗階段;
Sangamo Therapeutics資助的編號為NCT03432364的AStudy to Assess the Safety, Tolerability, and Efficacy of ST-400 for Treatment of Transfusion-Dependent Beta-thalassemia (TDT)項目,基于鋅指核酸酶(ZFN)技術,再編輯病人自身血液干細胞而后再回輸目前已進入2期臨床試驗。在近日的ASH上也公布了最新數據,表明基因療法值得進一步探索;Bluebird bio資助的編號為NCT01745120的A Study Evaluating the Safety and Efficacy of the LentiGlobin BB305 Drug Product in β-Thalassemia Major Participants項目,基于LentiGlobin BB305 lentiviral vector編輯病人自身CD34+造血干細胞 已經進入3期臨床,且在今年6月,基因治療藥物Zynteglo (LentiGlobin)在歐洲獲得批準上市(價格為177萬美元),成為繼5月份 FDA批準治療脊髓性肌萎縮的Zolgensma(開發商為諾華,價格約為210萬美元)之后第二款超過100萬美元價格上市的藥物,也是目前全球第二昂貴的藥物;
GlaxoSmithKline資助的編號為NCT03275051的Long-term Follow-up of Subjects Treated With OTL-300 for Transfusion Dependent Beta-thalassemia Study (TIGET-BTHAL)項目,基于用編碼人β珠蛋白基因的慢病毒載體(globe)遺傳修飾的自體造血干細胞/祖細胞分化簇(CD)34+細胞回輸病人體內,目前處于臨床1/2期試驗階段;IRCCS San Raffaele資助的編號為NCT02453477的Gene Therapy for Transfusion Dependent Beta-thalassemia項目,基于GLOBE lentiviral 編輯病人自體造血干細胞并回輸,目前處于臨床1/2期試驗階段。關于地貧的介紹本期就到這里了,大家是否對這個疾病又有了重新的認識呢。面對患者群體不斷上升,希望我們可以不斷推動地貧及其他罕見病在社會上的關注度,讓更多患者獲得治療,重返正常生活。
參考文獻
【1】李慧媛,楊仁池.遺傳性血液病研究進展[J].中國科學:生命科 學,2017,47(12):1306-1312.
【2】葉向化,我國的地中海貧血癥[J].鐵道醫學,1980(09).
【3】中國地中海藍皮書(2015)
【4】中國罕見病藥物可及性報告,2019
【5】中國第一批罕見病目錄,2018
【6】《地中海貧血預防控制操作指南》,主編:徐湘民