Seahorse XF細胞能量代謝分析技術在諾貝爾生理和醫學獎相關領域的應用
2019年諾貝爾生理或醫學獎在瑞典卡洛琳斯卡醫學院揭曉,哈佛醫學院的William G. Kaelin,牛津大學的Peter J. Ratcliffe以及約翰霍普金斯大學的Gregg L. Semenza教授因在“發現細胞如何感知和適應氧氣變化”領域做出的卓越貢獻,被授予這一科學界最高獎項。

圖1:獲獎的三位科學家
眾所周知,哺乳動物需要利用氧氣將食物轉化成可供使用的生物能量。此次諾貝爾獎獲得者開創性地揭示了細胞感應氧氣的分子機制,闡明了氧氣含量是如何影響細胞代謝和生理功能的,為包括腫瘤、心血管病、慢性腎臟貧血等多種疾病的臨床治療開辟了新路徑1。
三位科學家獲獎的核心成果是發現了低氧誘導因子1(HIF-1),其廣泛存在于慢性缺氧細胞中,它的表達水平受到氧氣含量的影響:在高氧狀態下,低氧誘導因子被修飾,從而降解;在低氧狀態下,低氧誘導因子不被修飾,不會降解。HIF-1所調控的基因能夠作用于線粒體呼吸,還能夠動態調節糖酵解的速率。
氧氣消耗速率(OCR)和細胞外酸化速率(ECAR)是測定活細胞線粒體呼吸功能和糖酵解水平的金標準,安捷倫公司推出的Seahorse XF細胞能量代謝分析系統可廣泛應用于諾貝爾生理或醫學獎的相關研究領域。下面是幾位獲獎科學家使用Seahorse XF技術發表的文章:
2011年,Gregg L. Semenza組在Cell期刊上發表文章,發現丙酮酸激酶PKM2與脯氨酰羥化酶3(PHD3)的相互作用增強了PKM2與HIF-1α的結合,促進了HIF-1α靶基因的轉錄激活 2。他們進一步發現,PHD3可以羥基化403/408位的脯氨酸,PHD3的敲低會抑制PKM2共激活子的功能,減少癌細胞對葡萄糖的攝取、乳酸的產生,增加了氧消耗。在這篇文章中作者利用Seahorse XF技術測量了氧氣消耗速率OCR。如下圖:

圖2:敲低PHD3降低了腎癌細胞的胞內葡萄糖和胞外乳酸的水平,增加了氧消耗
2016年Semenza組又在Cancer Research發表文章,研究磷酸甘油酸脫氫酶(PHGDH)在乳腺癌干細胞的維持和肺轉移過程中的作用3。缺氧誘導HIF的表達,HIF作為轉錄因子進一步誘導PHGDH的表達。瘤內缺氧的環境會使乳腺癌干細胞富集,促進乳腺癌轉移和病人死亡。在這樣一個研究背景下,作者想要研究低氧時PHGDH是如何影響乳腺癌干細胞的。結果發現,敲低PHGDH 會顯著減少乳腺癌干細胞的富集。作者運用Seahorse XF技術來檢測PHGDH對細胞代謝的影響,結果表明,敲低PHGDH的乳腺癌細胞系MDA-MB-231和MCF-7的OCR和ECAR都上升,而葡萄糖的攝取并沒有改變。進一步的研究證實,PHGDH影響乳腺癌細胞對葡萄糖代謝物的利用。
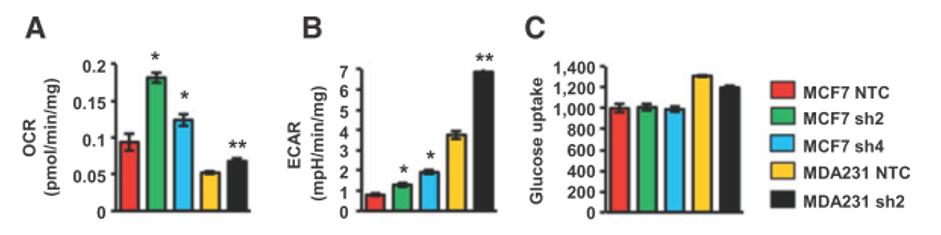
圖3:PHGDH的敲低使乳腺癌細胞的氧消耗和糖酵解水平升高
2010年,另外一位獲獎者William G. Kaelin組同樣使用Seahorse XF技術在Circulation期刊上發表文章,研究脯氨酰羥化酶(PHD)在心臟中的功能4。作者發現心臟PHD的特異性失活和HIF的長期激活,足以引起很多缺血性心肌病的癥狀。在研究PHD如何影響心臟功能的時候,作者采用了Seahorse XF技術。如下圖:
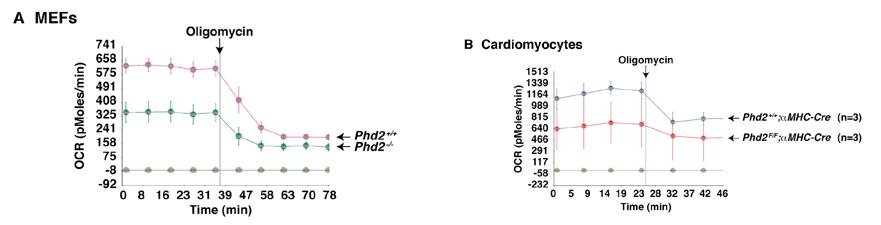
圖4:PHD2缺陷的小鼠胚胎成纖維細胞和心肌細胞的氧消耗降低
除了在基礎科研領域大放異彩,HIF的研究成果也被用到了制藥行業中。獲獎科學家中的William G. Kaelin教授,是琺博進(中國)醫藥技術開發有限公司的科學顧問委員會成員。琺博進基于Kaelin教授獲諾貝爾獎的低氧誘導因子機制研發的羅沙司他 (Roxadustat)已于2018年12月18日在中國首先獲批上市。羅沙司他是全球獲批的首個小分子低氧誘導因子脯氨酰羥化酶(HIF-PH)抑制劑類貧血藥物。HIF不僅使紅細胞生成素表達增加,也能使紅細胞生成素受體以及促進鐵吸收和循環的蛋白表達增加。羅沙司他通過模擬脯氨酰羥化酶(PH)的底物之一酮戊二酸來抑制PH酶,影響PH酶在維持HIF生成和降解速率平衡方面的作用,從而達到糾正貧血的目的。治療慢性腎臟貧血是該藥的第一個適應癥。目前許多科學家,例如Anna Baulies5和Takemura K6還在繼續研究羅沙司他對癌癥和骨骼肌的作用,在他們發表的論文中,也均使用了安捷倫的SeahorseXF技術。
從生命科學研究領域到生物制藥領域,Agilent Seahorse XF技術以其專業獨特的分析測試技術,正在為科研工作者提供更深入的細胞功能洞察力。更多Agilent Seahorse XF相關科研文獻查詢,請點擊安捷倫細胞分析出版物數據庫:https://www.agilent.com/publications-database/.
參考文獻
1 Thompson, C. B. Into Thin Air: How We Sense and Respond to Hypoxia. Cell 167, 9-11, doi:10.1016/j.cell.2016.08.036 (2016).
2 Luo, W. et al. Pyruvate kinase M2 is a PHD3-stimulated coactivator for hypoxia-inducible factor 1. Cell 145, 732-744, doi:10.1016/j.cell.2011.03.054 (2011).
3 Samanta, D. et al. PHGDH Expression Is Required for Mitochondrial Redox Homeostasis, Breast Cancer Stem Cell Maintenance, and Lung Metastasis. Cancer Res 76, 4430-4442, doi:10.1158/0008-5472.CAN-16-0530 (2016).
4 Moslehi, J. et al. Loss of hypoxia-inducible factor prolyl hydroxylase activity in cardiomyocytes phenocopies ischemic cardiomyopathy. Circulation 122, 1004-1016, doi:10.1161/CIRCULATIONAHA.109.922427 (2010).
5 Baulies, A. et al. The 2-oxoglutarate carrier promotes liver cancer by sustaining mitochondrial GSH despite cholesterol loading. Redox Biol 14, 164-177, doi:10.1016/j.redox.2017.08.022 (2018).
6 Takemura, K., Nishi, H., Higashihara, T. & Nangaku, M. SUN-285 PHD inhibitor and hypoxia influence on skeletal muscle glucose metabolism. Kidney International Reports 4, doi:10.1016/j.ekir.2019.05.790 (2019).





