昨日明星LncRNA搭上m6A后逆襲為今天新星
m6A RNA甲基化是當前在LncRNA,環狀RNA等非編碼RNA之后最為火熱的科研明星,到底有多火?擺出數據告訴你!
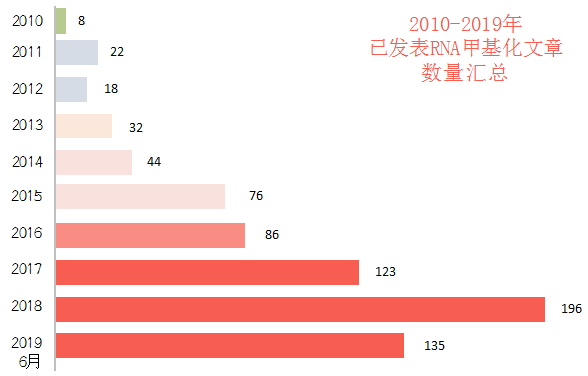
2019年才過去一半還不到,已發表文章數就已占去年的7成。RNA甲基化領域,不僅文章數量多,高分文章也有許多。據統計,僅2019年上半年就發表了多篇Nature,Cell,Cell Stem Cell,Nature Immunolgy這類的頂級期刊,10分以上m6A文章就有18篇之多。
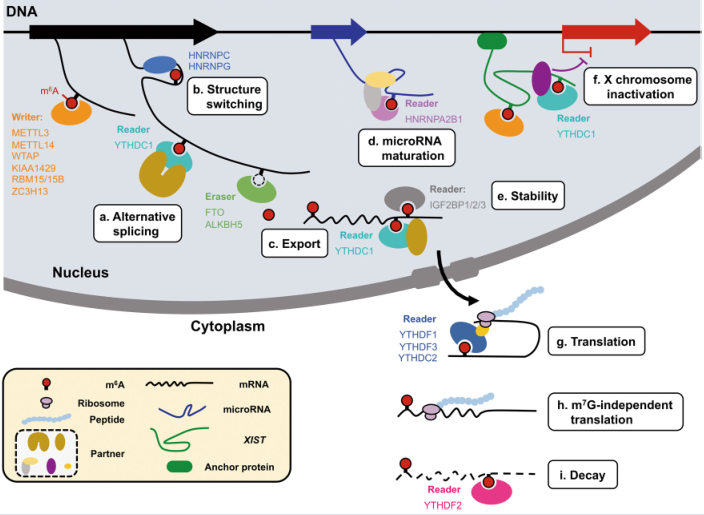
m6A RNA甲基化作為2018年國自然熱點,申請的課題主要圍繞writer,eraser和reader。
做膩了writer,eraser?那讓我們來看看reader,YTHDF家族由于在核外參與蛋白翻譯和降解,是reader里最明星的研究對象,可m6A reader酶千千萬萬,您研究的基因除了YTHDF家族外,可能還與其他reader結合。
做膩了writer,eraser?那讓我們來看看reader,YTHDF家族由于在核外參與蛋白翻譯和降解,是reader里最明星的研究對象,可m6A reader酶千千萬萬,您研究的基因除了YTHDF家族外,可能還與其他reader結合。
今天,讓我們開開腦洞,談一談另一個reader hnRNPA2B1,看看像這類核內核外都有表達的reader是怎么來做研究的。
文章導讀
結直腸癌Colorectal cancer(CRC)是一類腸道發生癌變的疾病。目前,關于CRC發生和轉移相關的分子機制還未有詳細報道。已有研究指出,LncRNA分子在腫瘤發生,發展,甚至是遷移的過程中發揮重要機制。因此,本文以LncRNA為切入點,首先通過LncRNA測序找到一個目標LncRNA---RP11,在CRC中高表達的趨勢,且表型與細胞遷移正相關。接著,通過RNA Pull Down-質譜技術,證實該LncRNA與下游蛋白hnRNPA2B1是直接結合關系,該蛋白可是m6A RNA修飾的明星閱讀酶(Reader)呀!那這個LncRNA勢必也參與了m6A RNA 甲基化的過程。接下來,讓我們跟隨作者思路,看看LncRNA結合m6A的機制類文章是怎么做的。

發表期刊:Molecular Cancer
影響因子:7.8
實驗方法:LncRNA 測序,MeRIP-qPCR,RNA Pull Down,RIP,LncRNA定量PCR,mRNA定量PCR
實驗材料:CRC臨床樣本等,結直腸癌細胞系等
影響因子:7.8
實驗方法:LncRNA 測序,MeRIP-qPCR,RNA Pull Down,RIP,LncRNA定量PCR,mRNA定量PCR
實驗材料:CRC臨床樣本等,結直腸癌細胞系等
文章內容
1. LncRNA RP11在CRC細胞和組織中高表達
CRC組織(癌癥1期和癌癥3期)與癌旁組織分別進行LncRNA測序(云序可提供此服務),篩選到在癌癥1期和3期都差異高表達的LncRNA---RP11。在測序樣本和32個臨床樣本組織中,通過LncRNA 定量PCR證實其在實驗組中高表達。已有結腸癌和直腸癌數據庫結果也證實這類表達趨勢。RP11在多個結直腸癌細胞系中廣泛表達,并在CRC患者轉移性淋巴結組織原代培養的SW620細胞中高表達。
CRC組織(癌癥1期和癌癥3期)與癌旁組織分別進行LncRNA測序(云序可提供此服務),篩選到在癌癥1期和3期都差異高表達的LncRNA---RP11。在測序樣本和32個臨床樣本組織中,通過LncRNA 定量PCR證實其在實驗組中高表達。已有結腸癌和直腸癌數據庫結果也證實這類表達趨勢。RP11在多個結直腸癌細胞系中廣泛表達,并在CRC患者轉移性淋巴結組織原代培養的SW620細胞中高表達。
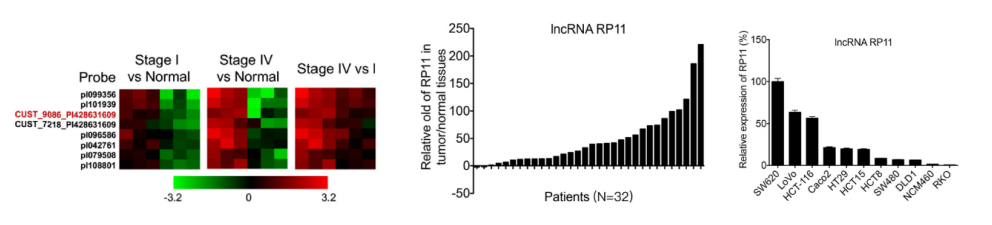
圖1. RP11在CRC組織和細胞中高表達
2.RP11在體內和體外誘導CRC細胞散布
為進一步闡明RP11在體內和體外的功能機制。作者首先證實RP11過表達細胞系能夠顯著促進細胞的遷移能力。由于此過程影響了E-Cad,FN和Vim等標志物蛋白的表達量,因此可能與EMT和癌癥轉移相關。接著,作者在異種移植腫瘤的裸鼠體內高表達RP11基因,發現該基因能夠促進腫瘤的增殖。作者在裸鼠體內通過尾部注射方式,導入穩定高表達RP11的癌癥細胞,飼養8周后,發現這些細胞轉移至小鼠肝臟組織中。
為進一步闡明RP11在體內和體外的功能機制。作者首先證實RP11過表達細胞系能夠顯著促進細胞的遷移能力。由于此過程影響了E-Cad,FN和Vim等標志物蛋白的表達量,因此可能與EMT和癌癥轉移相關。接著,作者在異種移植腫瘤的裸鼠體內高表達RP11基因,發現該基因能夠促進腫瘤的增殖。作者在裸鼠體內通過尾部注射方式,導入穩定高表達RP11的癌癥細胞,飼養8周后,發現這些細胞轉移至小鼠肝臟組織中。
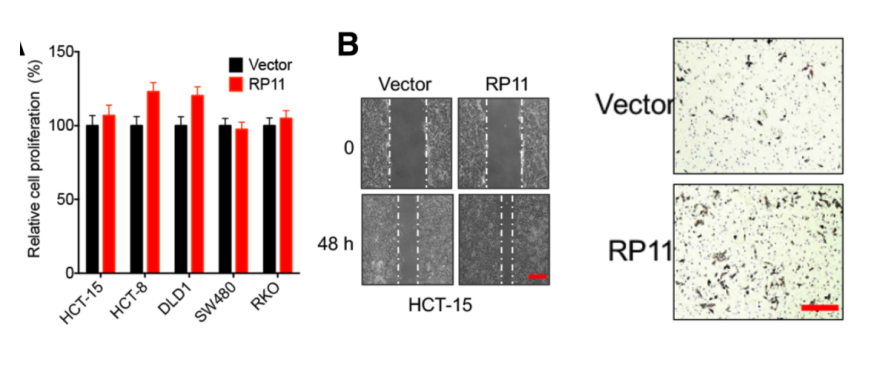
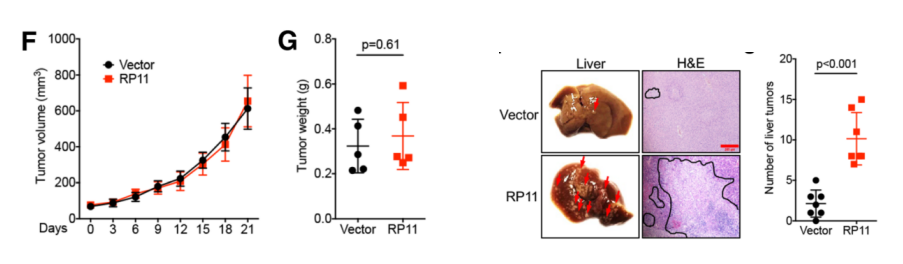
圖2. 體外:RP11促進癌細胞遷移
體內:RP11促進癌組織增殖和遷移
體內:RP11促進癌組織增殖和遷移
3.轉錄因子Zeb1介導RP11調控CRC細胞散布
已有研究表明,LncRNA能夠通過順勢調控機制影響其周圍的轉錄本表達。因此,本研究在LncRNA RP11周圍找到了6個轉錄本,分別為NUDT12, C5orf30, PPIP5K2, GIN1, RP11-6 N13.1和CTD-2374C24。通過mRNA定量PCR證實以上轉錄本不管是在RP11高表達組以及RP11表達量最高的SW620細胞系中,都未差異表達。所以,RP11的功能機制不是通過順勢調控的模式影響的。
已有研究表明,LncRNA能夠通過順勢調控機制影響其周圍的轉錄本表達。因此,本研究在LncRNA RP11周圍找到了6個轉錄本,分別為NUDT12, C5orf30, PPIP5K2, GIN1, RP11-6 N13.1和CTD-2374C24。通過mRNA定量PCR證實以上轉錄本不管是在RP11高表達組以及RP11表達量最高的SW620細胞系中,都未差異表達。所以,RP11的功能機制不是通過順勢調控的模式影響的。
既然不是順勢調控引起的,那還會是什么呢?
是否是下游結合蛋白呢?
為了證實以上猜想,作者在過表達細胞中通過mRNA定量PCR技術,檢測了多個與EMT相關因子的表達量,檢測結果顯示Zeb1與RP11的表達模式正相關。并且在Zeb1過表達細胞系中,證實能夠影響FN和Vim標志物的表達量。因此,RP11的下游可能是Zeb1。
為了驗證前面的猜想,作者通過Zeb1 RIP-LncRNA PCR(云序可提供此服務)和RP11 Pull Down-質譜技術(云序可提供此服務),證實Zeb1與RP11在mRNA和蛋白層面都不是直接結合的關系。
為了證實以上猜想,作者在過表達細胞中通過mRNA定量PCR技術,檢測了多個與EMT相關因子的表達量,檢測結果顯示Zeb1與RP11的表達模式正相關。并且在Zeb1過表達細胞系中,證實能夠影響FN和Vim標志物的表達量。因此,RP11的下游可能是Zeb1。
為了驗證前面的猜想,作者通過Zeb1 RIP-LncRNA PCR(云序可提供此服務)和RP11 Pull Down-質譜技術(云序可提供此服務),證實Zeb1與RP11在mRNA和蛋白層面都不是直接結合的關系。
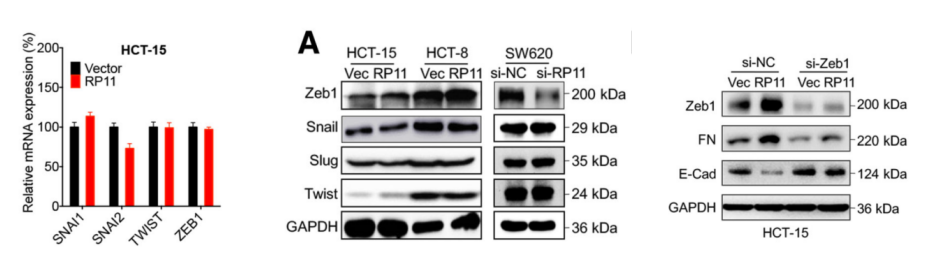
圖3. Zeb1可能是RP11間接的下游
4.RP11-hnRNPA2B1-mRNA復合體參與RP11調控Siah1和Fbxo45
同樣的,作者推測下游蛋白可能是Siah1和Fbxo45。在mRNA層面,通過RP11 RIP-mRNA PCR,證實兩者調控了RP11和Zeb1的表達。在蛋白層面,通過RP11 Pull Down-質譜技術證實三者并非直接結合。
同樣的,作者推測下游蛋白可能是Siah1和Fbxo45。在mRNA層面,通過RP11 RIP-mRNA PCR,證實兩者調控了RP11和Zeb1的表達。在蛋白層面,通過RP11 Pull Down-質譜技術證實三者并非直接結合。
那到底是什么蛋白連接著三者呢?
為證實RP11是如何調控下游mRNA Siah1和Fbxo45,作者在前期RP11 Pull down-質譜結果中,找到與RP11直接結合的hnRNPA2B1蛋白。hnRNPA2B1 RIP-mRNA PCR實驗證實RP11,Siah1和Fbxo45在mRNA層面是直接結合的關系。已有研究表明hnRNP2B1是一種RNA結合蛋白,在細胞核及細胞質中廣泛分布。通過結構分析LncRNA結構,證實其能夠與Siah1的CDS區和Fbxo45的3’UTR區結合。總的來說,RP11通過形成RP11-hnRNPA2B1-mRNA復合體調控下游mRNA Siah1和Fbxo45的表達。
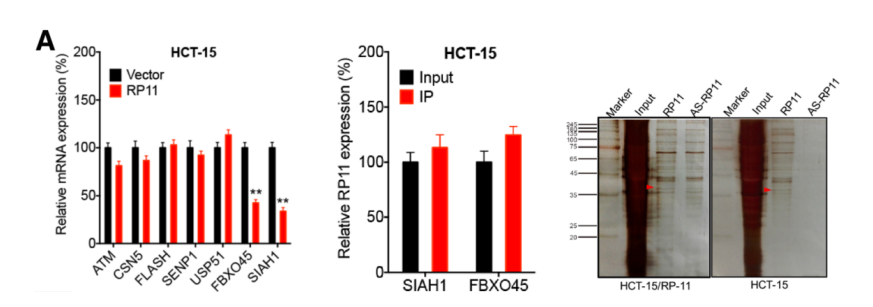
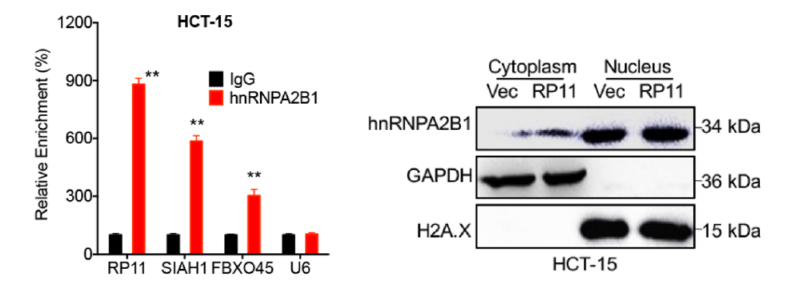
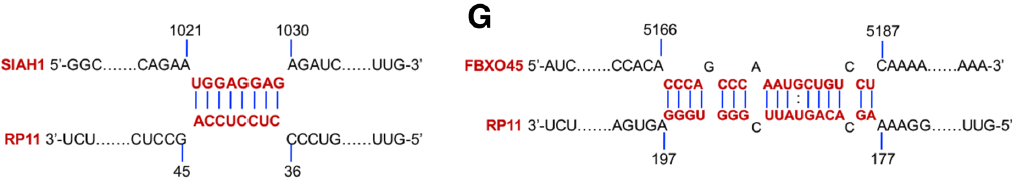
圖4. RP11形成RP11-hnRNPA2B1-Siah1-Fbxo45復合體參與細胞遷移
5. m6A修飾參與CRC細胞中RP11表達上調機制
首先,作者懷疑RP11的高表達與DNA甲基化相關,通過DNA甲基化抑制酶處理細胞后,發現RP11表達量不變,證實在CRC細胞中RP11表達量與DNA甲基化無關。同時,實驗也證實其與組蛋白乙酰化無關。
首先,作者懷疑RP11的高表達與DNA甲基化相關,通過DNA甲基化抑制酶處理細胞后,發現RP11表達量不變,證實在CRC細胞中RP11表達量與DNA甲基化無關。同時,實驗也證實其與組蛋白乙酰化無關。
那到底是什么修飾調控了RP11的表達呢?
已有研究表明m6A修飾調控LncRNA的表達及功能過程。作者通過MeRIP-qPCR技術(云序可提供此服務),在三種細胞系中都證實了RP11上發生了m6A RNA甲基化修飾。并且分別過表達甲基化轉移酶METTL3和去甲基化轉移酶ALKBH5都能夠影響RP11的表達。接下來,作者旨在CRC細胞中深入研究m6A 修飾是如何調控RP11表達的?首先,筆者借助Act-D物質抑制轉錄過程,發現在Mettl3過表達組中RP11的表達量沒有受到影響,原因可能是Mettl3促進RP11在染色質中積累,從而對RP11的表達起到了穩定作用。m6A reader蛋白hnRNPA2B1參與了此過程。
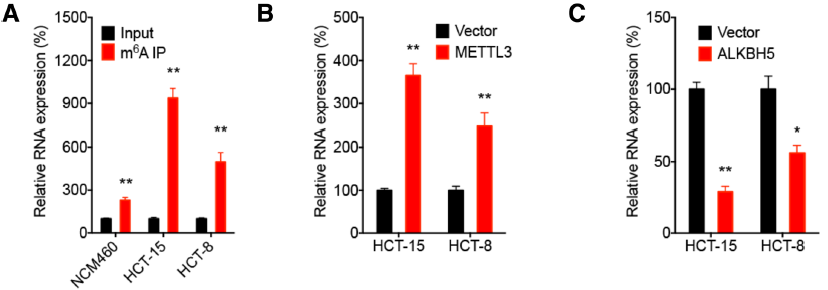
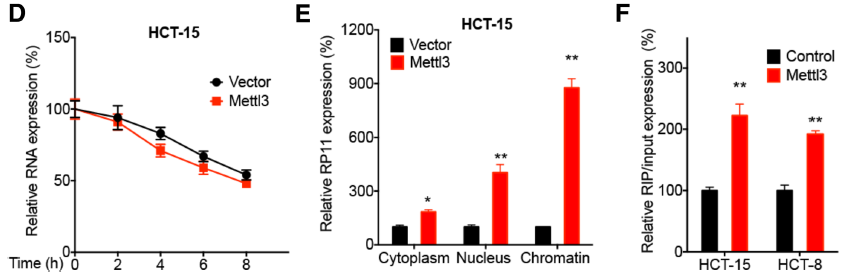
圖5. RP11存在m6A修飾并受Mettl3和AlKBH5調控
6. m6A/RP11/Zeb1間的關系和CRC細胞體內的進展
通對分析大量不同分期臨床樣本表達情況表明m6A修飾先調控RP11,RP11在影響Siah1-Fbxo45/Zeb1。借助KM曲線,作者發現高表達RP11直腸癌患者的生存情況并不樂觀。同時,也分析了下游基因與病人其他臨床指標間的關系。總體而言,證實了m6A/RP11/Zeb1促進了CRC的發生發展過程。
通對分析大量不同分期臨床樣本表達情況表明m6A修飾先調控RP11,RP11在影響Siah1-Fbxo45/Zeb1。借助KM曲線,作者發現高表達RP11直腸癌患者的生存情況并不樂觀。同時,也分析了下游基因與病人其他臨床指標間的關系。總體而言,證實了m6A/RP11/Zeb1促進了CRC的發生發展過程。
總結
在本研究中,作者首先通過LncRNA高通量測序手段,在CRC疾病組中篩到高表達的LncRNA----RP11,并證實其能夠促進腫瘤遷移。
隨后,作者旨在研究RP11下游結合蛋白是什么,是如何調控促進遷移表型的。
一方面:借助LncRNA Pull Down,快速鎖定與RP11結合的蛋白就是m6A reader hnRNPA2B。通過RIP-PCR,快速找到與該蛋白結合的RNA是RP11。另一方面,借助MeRIP-qPCR,證實在3種疾病相關細胞系中RP11上都存在著m6A 修飾的情況。同時,Mettl3作為其上游促進RP11穩定性,從而促進CRC的發生發展。
在本研究中,作者首先通過LncRNA高通量測序手段,在CRC疾病組中篩到高表達的LncRNA----RP11,并證實其能夠促進腫瘤遷移。
隨后,作者旨在研究RP11下游結合蛋白是什么,是如何調控促進遷移表型的。
一方面:借助LncRNA Pull Down,快速鎖定與RP11結合的蛋白就是m6A reader hnRNPA2B。通過RIP-PCR,快速找到與該蛋白結合的RNA是RP11。另一方面,借助MeRIP-qPCR,證實在3種疾病相關細胞系中RP11上都存在著m6A 修飾的情況。同時,Mettl3作為其上游促進RP11穩定性,從而促進CRC的發生發展。
云序推薦技術路線
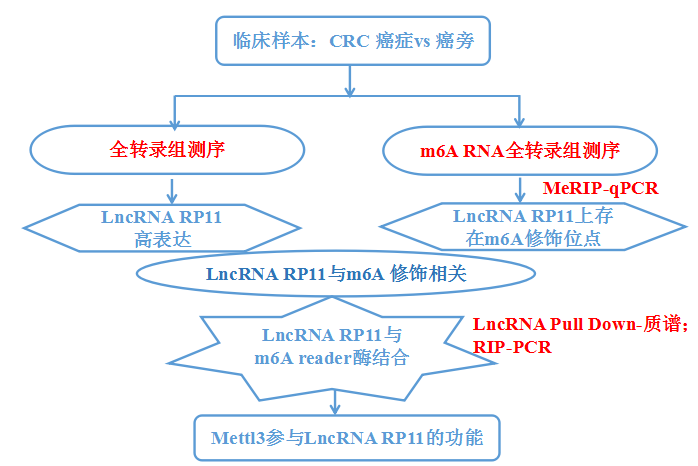
紅色字體部分的實驗,云序提供一站式服務
云序生物國內獨家提供RNA甲基化測序一站式服務
云序生物提供比色法檢測整體m6A甲基化修飾水平、RNA甲基化測序、MeRIP-qPCR驗證、RIP和RNA Pull Down機制研究服務。RNA甲基化測序技術是真正實現m6A,m5C和m1A修飾,檢測分子除mRNA外,還能檢測環狀RNA,LncRNA及其他非編碼RNA。2016年至今,樣本數量累積超過5000+,MeRIP富集成功率高達98%以上。
現在,為解決客戶樣本量少的問題,特推出超微量MeRIP測序技術,500ng總RNA既可進行測序實驗。特殊樣本也可進行RNA甲基化測序,如血清,血漿,外泌體和石蠟樣本。
云序生物提供比色法檢測整體m6A甲基化修飾水平、RNA甲基化測序、MeRIP-qPCR驗證、RIP和RNA Pull Down機制研究服務。RNA甲基化測序技術是真正實現m6A,m5C和m1A修飾,檢測分子除mRNA外,還能檢測環狀RNA,LncRNA及其他非編碼RNA。2016年至今,樣本數量累積超過5000+,MeRIP富集成功率高達98%以上。
現在,為解決客戶樣本量少的問題,特推出超微量MeRIP測序技術,500ng總RNA既可進行測序實驗。特殊樣本也可進行RNA甲基化測序,如血清,血漿,外泌體和石蠟樣本。
全文鏈接:
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-019-1014-2
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-019-1014-2
往期回顧:
上海云序生物科技有限公司
Shanghai Cloud-seq Biotech Co., Ltd.
地址:上海市松江區莘磚公路 518 號 20 號樓 3 樓
電話:021-64878766
傳真:021-64878766
網址:www.cloud-seq.com.cn
郵箱:market@cloud-seq.com.cn
Shanghai Cloud-seq Biotech Co., Ltd.
地址:上海市松江區莘磚公路 518 號 20 號樓 3 樓

電話:021-64878766
傳真:021-64878766
網址:www.cloud-seq.com.cn
郵箱:market@cloud-seq.com.cn
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





