潮汐反應器技術在以VERO細胞為載體生產日本腦炎病毒(JEV)疫苗領域的應用
潮汐反應器技術在以VERO細胞為載體生產日本腦炎病毒(JEV)疫苗領域的應用
背景介紹
日本腦炎病毒(JEV)于1934年首次從一例致命的人類病例的大腦中分離出來。雖然有癥狀的日本腦炎很少見,但病死率可高達30%。在那些幸存下來的人當中,30-50%遭受性的智力、行為或神經問題。東南亞和西太平洋地區有30多億人可能受到JEV感染,因此接種疫苗是預防措施。
日本腦炎疫苗的開發始于20世紀40年代福爾馬林滅活小鼠腦源性疫苗。盡管在誘導保護性免疫應答方面有效,但最后一批小鼠源疫苗已于2011年5月用完,因為當今國際乙腦疫苗開發標準不再允許這種生產方法。
在這篇白皮書中,我們描述了使用填充床細胞培養系統開發日本腦炎疫苗的過程。我們提供了一種具有成本效益的生物處理解決方案和一種適用于替代小鼠腦源性疫苗的制造工藝。
概述
使用含有胎牛血清的MEM培養基,將VERO細胞接種在充滿片狀載體(BioNOCⅡ)的500mL潮汐式生物反應器細胞培養瓶中(VacciXcell CelCradle-500AP)。在接種培養96小時后,可以收獲的細胞數量為1.2x109。在培養倍增時間方面,細胞在潮汐式生物反應器CelCradle (CC)上培養需要32小時,而在T-175培養瓶上則需要40小時。這一數據結果清楚地說明了潮汐式生物反應器技術能夠為細胞提供更好的生長條件,原因是此項技術增加了細胞和培養基之間營養成分以及氧氣的有效交換。
使用日本腦炎病毒株以感染倍數(multiplicity-of-infection MOI) 0.01感染VERO細胞。在病毒感染后,每天收獲一部分病毒液,并補充等量新鮮培養基,能連續培養收獲超過7天的病毒液。收獲液的病毒滴度采用“黃金標準”,即斑檢測法(Plaque Assay)為檢測病毒感染顆粒滴度的方法測定。最終,1臺潮汐式生物反應器CelCradle能可獲收1.11x1011 plaque-forming unit (pfu)總體病毒滴度。
材料
|
設備 |
細胞系/產品 |
完全培養基 |
接種細胞數 |
|
Celcradle - 500 AP |
VERO細胞系/ JEV |
MEM/ 10%FBS/ 2mM L-Glutamine |
1.4 x108 |
表1:執行階段-Vero單元擴展所需的材料.
階段:Vero細胞的接種和增殖
使用胰蛋白酶消化法從4個T-175細胞培養瓶上收獲細胞,收集起來,400 x g,3 min離心洗滌,共收獲1.4x108個細胞,添加120ml完全培養基,吹打混勻,將細胞懸液轉移到一個帶白帽的潮汐式生物反應器CelCradle- 500AP一次性培養瓶中。將此細胞培養瓶倒置,進行細胞貼壁接種,注意要使片狀載體全部浸沒于細胞懸液中。將培養瓶置于37°C二氧化碳培養箱中孵育3小時,每15-30分鐘拿出細胞培養瓶,輕輕搖晃,使細胞均勻接觸營養成分和氧氣。1小時后,播種效率達99.51%。為使附著細胞增殖,向培養瓶添加培養基體積達500mL,與裝有2.2 L培養基的灌注瓶連接,置于平臺上,參數設置如下:
|
CelCradle培養基體積 |
TideMotion潮汐式的參數 |
增殖周期 |
|
500mL |
Uprate: 1 mm/sec Uphold: 10 sec Downrate: 1 mm/sec Downhold: 10 sec |
96小時 (4天) |
|
灌注瓶培養基體積 |
灌注參數 |
|
|
2200mL |
Pump 1 Volume: 1999 ml Cycles/Day: 24 Schedule: 1111111 |
表2:階段celbradle階段生長和灌注參數概述:vero細胞擴展
每天取載體進行:(1)CVD計數;(2)甲醇/臺盼藍染色法觀察細胞增殖及在基質中的分布。
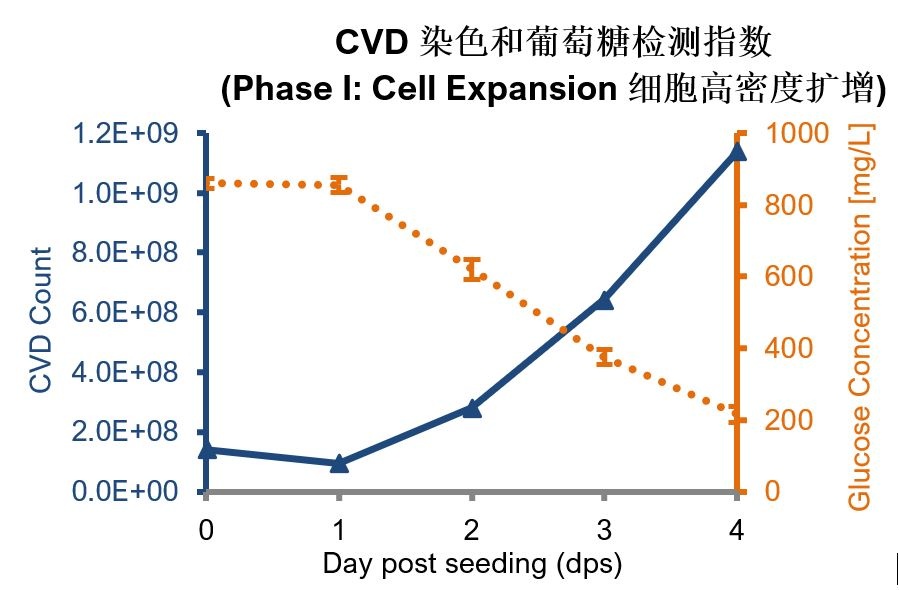

圖1:(頂部)每天使用CVD對CelCradle-500AP瓶中至少10個隨機選擇的載體進行細胞計數。(下):固定3個載體甲醇,RTP染色1x臺盼藍染色5min, PBS沖洗2次,顯微鏡下觀察。
第二階段:病毒接種和傳播
VERO細胞感染JEV, MOI為0.01,總體積為500ml。病毒接種及7天傳播參數如下:
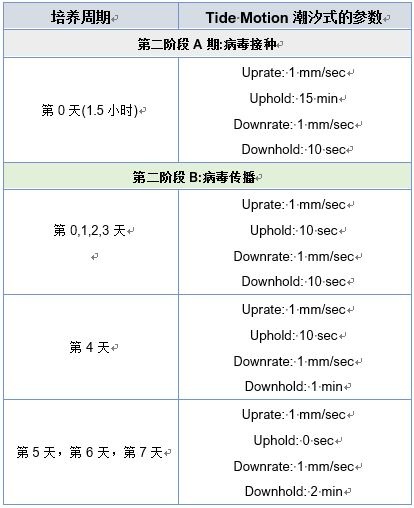
表3:執行第二階段的CelCradle階段參數概述。
采集含有病毒產品的培養基,并在七天的不同時間用新鮮培養基替換:
表4:第二階段七天內收獲和新鮮介質補充時間點一覽表。

圖2: (上)每天用葡萄糖細胞儀測量血糖濃度。藍色箭頭表示上清液收獲(470mL)與相同數量的新鮮培養基更換。葡萄糖[G;綠色字體]及/或谷氨酰胺[Glut;綠色字體]及/或碳酸氫鈉[SB;紫色字體)。(下) :0dpi和7dpi隨機從CelCradle瓶中抽取3片載體。使用甲醇固定,添加1x臺盼藍,染色5min,快速熱處理, PBS沖洗2次,在顯微鏡下觀察。
第三階段: 斑檢測法(Plaque Assay)測量JEV毒液滴度
從感染后的第2天到第7天,每天采集含病毒上清液。完成的收獲之后,將含病毒上清液保存在-80°C。病毒滴度分析測定使用“黃金標準”,即斑檢測法,或者其它已經公布開放了的方案。
圖3:CelCradle-500 AP,斑塊形成單位的滴度(感染性JEV)。
表5CelCradle - 500 A,收獲液的滴度(感染性JEV)。
2D和3D細胞培養:病毒生產量的比較
對比二維培養如T-175細胞培養瓶以及三維培養如潮汐式生物反應器CelCradle,對病毒的繁殖生產的影響,一個潮汐式生物反應器CelCradle細胞培養瓶生產的JEV含量相當于21個T-175細胞培養瓶生產的JEV病毒滴度含量。

討論
潮汐式生物反應器技術能確保細胞的高密度擴增、增殖以及最終收獲產品的高產。它的獨特之處在于創造了一個結合高氧傳遞和低剪切力的利于貼壁細胞增殖的環境。預期的優良藥品制作規范生產模式制生產(Good Manufacturing Practice)量將要求達到一個500L的生物反應器規模,并且還需要更加廣泛性的優化生產工藝,以降低產品成品,增加產品產量,另外,還需要確定關鍵的工藝參數,以提高GMP模式制生產過程水平。在這里,由于潮汐式生物反應器CelCradle采用了大型潮汐式生物反應器TideCell相同的潮汐反應技術原理,并且因其占地面積小且體積小,可以更加靈活地應用于生產工藝的優化以及新工藝的開發。
在這項概念性驗證研究中,我們已經證明潮汐式生物反應器CelCradle-500AP可以應用于Vero細胞的培養和JEV疫苗生產工藝。1個潮汐式生物反應器CC-500AP培養瓶的總病毒產量為1.06x1011 pfu (plaque assay));然而,一個潮汐式生物反應器CC-500AP培養瓶的體積與一個T-175培養瓶相似,但前者的病毒產量是后者的21倍的。值得注意的是,在未優化的培養條件下,依然收獲了滴度如此高的終產品,繼續優化培養條件,可以預料會收獲更加令人振奮的結果,后續的試驗將進一步探索以及確定Vero細胞培養和JEV生產工藝的的操作參數以便可以提高產量。
© 2019 Esco Aster Pte Ltd. All rights reserved. All trademarks are the property of Esco unless otherwise specified.





