應用MD微孔板讀板機和雙報告系統檢測NF-κB活性
前言
報告基因對于基因表達的研究來說是非常有用的工具,它可以代替要研究的目的基因,從而幫助我們了解目的基因的信號通路和相關的疾病。熒光素酶是最常用的報告基因,使用光度計和化學發光功能的微孔板讀板機我們可以很容易的檢測到熒光素酶,另一方面,由于在細胞實驗中其背景較低,因此具有很高的靈敏度。我們通常用螢火蟲熒光素酶表達水平高低反映出我們感興趣的基因在系統中的地位。而海腎來源的熒光素酶則更常在多熒光實驗中作為第二種報告基因,來規范化多種在不同樣本中變化較大的指標如轉染效率,細胞活力等。
SpectraMax® DuoLuc™ Reporter 試劑盒可以對哺乳動物細胞中的螢火蟲和海腎熒光素酶進行高靈敏度的定量。依次向微板孔中加入兩種適量的反應試劑即可檢測熒光。這種雙熒光信號檢測系統可以在歸一化檢測熒光信號(螢火蟲熒光)的同時提供持續表達的對照熒光信號(海腎熒光)。運用SpectraMax® iD5 多功能微孔板讀板機、注射器系統和 SmartInject™ 技術可以將實驗條件最優化。
在這里我們將展示如何在哺乳動物細胞模型中, 通過雙熒光報告檢測系統和SpectraMax iD5微孔板讀板機來檢測核轉錄因子κB (NF- κB)的活性。NF- κB是參與細胞進程中許多基因表達的“主要調節者”,如炎癥,免疫,分化,增殖和凋亡。腫瘤壞死因子α (TNF- α)可以激活細胞信號通路來降解NF- κB的抑制劑,從而促使其釋放并進入核內,調節數百目的基因的表達。NF- κB通路的紊亂可以誘發多種疾病,如多發性硬化病,糖尿病,阿爾茲海默病等,因此利用合適的工具加深我們對NF- κB通路的理解是十分必要的。
優勢
• 靈敏的雙報告系統檢測多熒光素酶
• 用對照質粒轉染進行均一化,提高結果的準確度
• SoftMax Pro軟件的預置模板可簡化操作
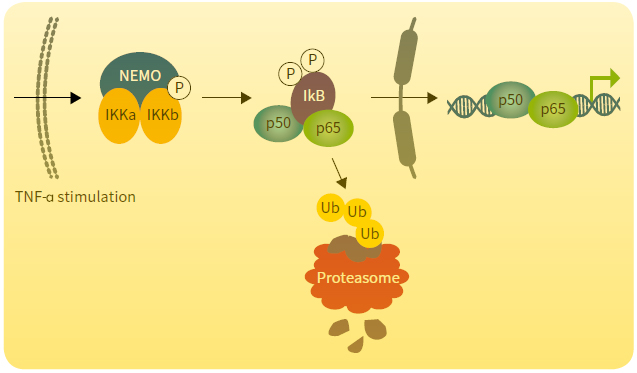
圖1 NF-κB信號通路。TNF-α激活信號層級反應使NF-κB抑制劑IKB降解,并釋放NF-κB轉錄因子。
材料
材料
• SpectraMax 雙報告試劑盒(Molecular Devices cat. #R8361)
• HEK 293 細胞系 (ATCC cat. #CRL-1573)
• 培養基: DMEM + 10% fetal bovine serum +penicillin/streptomycin
• pGL4.32[luc2P/NF-κB-RE/Hygro] 螢火蟲熒光素酶質粒 (Promega cat. #E849A)
• pGL4.75[hRluc/CMV] 海腎熒光素酶質粒(Promega cat. #E693A)
• FuGENE HD 轉染試劑盒(Promega cat. #E2311)
• Opti-MEM 低血清培養基(ThermoFisher Scientific cat. #31985062)
• 96孔白板 (Corning cat. #3610)
• TNF-α 10 μg/mL PBS + 1 mg/mL BSA溶液(Sigma cat. #T0157)
• BrightMax 密封薄膜(Excel Scientific cat. #WT-50)
• SpectraMax iD5 多功能微孔板讀板機
• 具有 SmartInject技術的注射器系統
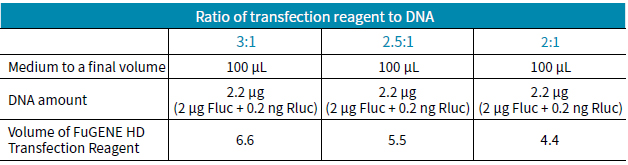
表1 轉染試劑體積與不同DNA含量的比例。
方法
細胞接種和轉染
HEK293細胞(80%融合度)用胰酶消化后分到96孔白板中,每孔15,000細胞。當細胞超過50% 融合度時,用NF- κB-RE 螢火蟲熒光素酶和海腎對照組質粒對細胞進行共轉染,其中使用三種不同比例FuGENE和DNA組合方式,轉然后,細胞置于37°C培養箱中培養24h。
TNF-α誘導
將10 μg/mL TNF-α的溶液用細胞培養基稀釋到20ng/ml制成誘導溶液。無添加培養基作為對照。操作時將原培養基移除后加入100μL對照或誘導溶液,之后將板放回培養箱繼續孵育7小時。
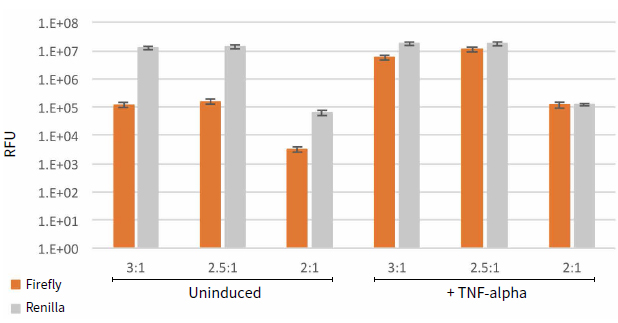
圖2 原始發光值數據。圖中所示為不同轉染條件下(轉染試劑:DNA比值)TNF-α未誘導和誘導的RFU值。每個轉染條件有9個重復。
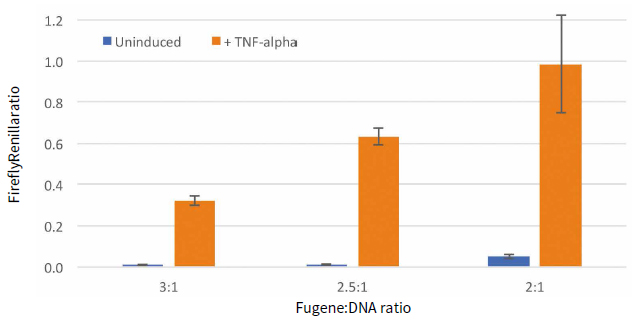
圖3 均一化發光值結果。用海腎發光值對螢火蟲RLU做均一化。
細胞裂解液的制備
移除細胞培養基后孔中細胞用PBS洗兩次。裂解緩沖液恢復至室溫后每孔加入20μL。室溫下溫柔震蕩15分鐘促進細胞裂解。在板底安上一個白板密封蓋以增強熒光信號強度。
熒光素酶檢測設定
試劑盒中的試劑使用前需在室溫下孵育。向裝有2 . 2 m g 凍干底物的小瓶中加入220μL水混勻后即為螢火蟲酶底物。向裝有440μg凍干底物的小瓶中加入220μL水混勻后即為水蛭素腸桿菌素。用螢火蟲檢測緩沖液按1:50比例稀釋螢火蟲酶底物后即為螢火蟲工作液。用海腎熒光素酶緩沖液按1:50比例稀釋水蛭素腸桿菌素后即為海腎工作液。對一個96孔板來說,每種工作液(working solution)我們需要11mL,其中包含220μL各自的底物(substrate)。SoftMax® Pro Software中預配置的程序可以幫助執行實驗操作和結果分析,這需要以下的參數設置:
1、使用注射器1向孔中加入100μL螢火蟲工作液
2、等2秒鐘使反應充分
3、設置integration time 5秒檢測螢火蟲熒光
4、使用注射器2向孔中加入100μL海腎工作液
5、等2秒鐘使反應充分
6、設置integration time 5秒檢測海腎熒光
7、對每個實驗孔,需要將第一次測量(firefly熒光)與第二次測量(海腎熒光)的RLU值相比獲得數據。
SpectraMax iD5注射器模塊和SmartInject技術可以在加入試劑的過程中進行震蕩,從而保證試劑充分混勻以最大限度的獲得螢火蟲和海腎的熒光信號。
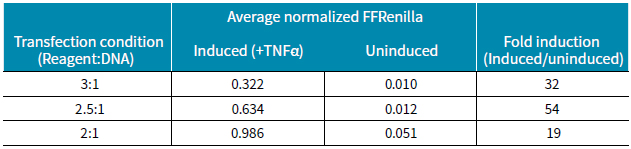
表2 在誘導與不誘導情況下不同轉染條件下獲得的比值。最好的條件是轉染試劑:DNA為2.5:1。
結果
相對于誘導條件的變化而言,各種轉染條件均能檢測到海腎熒光素酶的高表達,而加入細胞因子TNF-α會大大增加螢火蟲熒光素酶的表達水平(圖2)。總之,轉染試劑與DNA比例為2:1時熒光素酶的表達水平較其他比例而言最低。結果顯示誘導條件下,三種轉染比例條件下螢火蟲熒光素酶與海腎熒光素酶均一化讀值較高(圖3)。然而均一化比值在3:1和2.5:1的轉染條件下較低,但是加TNF- α誘導的與不加的倍比關系明顯較大。表2顯示三種轉染條件下誘導的倍比關系,最好的誘導倍比條件是試劑: DNA比例為2.5:1。
結論
在HEK293細胞系應用雙報告基因檢測法,我們證實了加入TNF-α強烈誘導NF-κB的表達。由于此系統對螢火蟲熒光素酶和海腎熒光素酶都敏感,都可得到較強的信號。三種轉染條件下,我們加入TNF-α誘導使NF-κB均一化后的最佳比值可達到54倍。
使用SpectraMax® iD5 多功能微孔板讀板機、具有SmartInject™ 技術的注射器系統,可用于檢測SpectraMax® DuoLuc™Reporter 實驗。預置的操作流程簡化了數據采集和分析的操作。SpectraMax Pro軟件可助你快速完整、靈敏可靠的獲得雙熒光素酶報告系統的檢測結果。
Reference
1. Oeckinghaus, A and Ghosh, S. The NF-κB Family of Transcription Factors and Its Regulation.
Cold Spring Harb Perspect Biol. 2009 Oct; 1(4): a000034.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com





