1. 細胞系:CHO-M1細胞系,表達內源G蛋白偶聯毒草堿1膽堿受體(ATCC,M1 WT3-CRL1985). 親本CHO-K1細胞用作陰性對照。
2. 抗體:兔抗ChRM1-PE標記,多抗(Bioss,Cat.#ABIN668656); 兔抗-CHRM1 多抗,無標記;(Bioss,Cat.#bs-1150R); 山羊抗兔IgG-PE標記,多抗(Life Technologies, Cat.#P2771MP)。
3. 培養基:Ham’s F12培養基(Corning cellgro, Cat.#10-080-CV);CloneMedia-CHO-S (Molecular Devices,Cat. #K8710); Fetal Bovine Serum (Hyclone, Cat.#SH30071.03), 1% Pen/Strep/Glutamine (Life Technologies,Cat. #10378016), 450 μg/mL Geneticin, G418 (LifeTechnologies, Cat. #10131035)。
4. 反應緩沖液:10X HBSS (Life Technologies, Cat.#14065056) 無菌水稀釋,注射用。(Irvine Scientific, Cat. #9309),20 mM HEPES (Life Technologies, Cat. #15630080). pH 調整到7.4。
5. FLIPR® Calcium 6 Assay Kits (Molecular Devices, Cat.#R8190)。
6. 微孔板: 6-well non-TC treated, clear-bottom plates (Greiner Bio-One, Cat. #657185); 384-well black-wall, sterile,TC-treated, clear-bottom plates (Corning, Cat. #3072)。
7. M1 AChR agonist: Carbamoylcholine chloride or Carbachol(Sigma, Cat. #C4382)。
儀器概述
ClonePix 2 系統
1. 篩選和挑取哺乳細胞克隆的自動化系統
2. 白光和熒光成像
3. 透射光支持低對比度克隆如單層貼壁細胞成像
4. 軟件控制5對激發/發射濾光片的切換
5. 用戶自定義標準進行克隆排序
6. 目標克隆識別和挑取到96孔目標板
7. 支持懸浮和貼壁細胞的多種應用
1. 篩選和挑取分泌抗原特異性抗體的雜交瘤細胞
2. 細胞系開發
CloneSelect Imager
1. 無標記的白光細胞成像技術
2. 客觀、定量評價細胞生長
3. 簡單、容易使用的軟件界面
4. 準確獲取96孔板每個孔細胞的生長率
5. 支持多種應用:
1. 監控細胞生長
2. 單克隆驗證
FLIPR Tetra 系統
1. 標準EMCCD熒光檢測或可選ICCD熒光和化學發光檢測
2. 用戶可配置96-、384-、和1536孔板
3. 用戶可更換的懸浮細胞選項
4. 獨特的,可配置激發光學拓展了熒光種類的應用
5. 直觀、容易使用的軟件界面
半固體培養基培養細胞
CHO-M1和CHO-K1細胞系:CHO-M1和親本CHO-K1細胞種在CloneMedia CHO(K8710)培養基中,每孔1000個細胞,37℃培養8-10天直到離散克隆形成。新傳代的細胞和前幾代的細胞分別種在培養基中,觀察M1 GPCR的不同表達水平。
直接標記的方法:PE標記的CHRM1抗體隨細胞直接加到半固體培養基中。對照孔包括細胞但是沒有抗體。
雙抗體方法:直接標記的方法沒有效果的時候,用一抗和二抗測試可行性。非標記的rabbit anti-muscarinic抗體和PE標記的抗兔多克隆二抗隨細胞直接加到半固體培養基中。對照孔包含細胞但沒有抗體,連同僅僅含有二抗的對照孔。
ClonePix2系統成像和挑取表達GPCR(M1)的細胞克隆
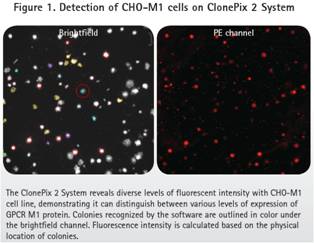
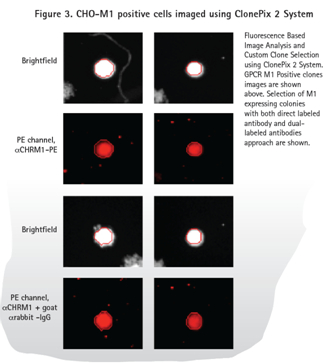
ClonePix2 成像和挑取陽性(CHO-M1)和陰性(CHO-K1)細胞。明場成像識別每個克隆的位置和形態,熒光成像識別高表達的M1。對PE標記的抗體,使用Cy5通道曝光6,000ms。
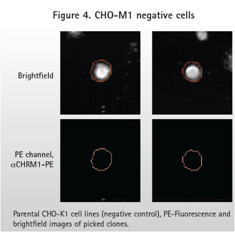
無論是直接標記方法還是雙抗體方法,根據ClonePix2的記錄,CHO-M1陽性細胞產生大范圍的熒光信號。圖1顯示了M1 GPCR不同程度的表達。正如預期,親本CHO-K1細胞沒有產生熒光信號。
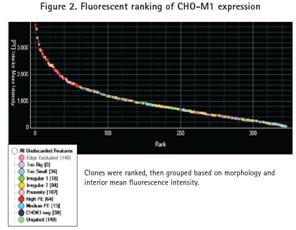
細胞基于形態和熒光強度被分組。挑取克隆的形態基于大小、形狀和克隆之間的鄰近度。形態學理想的克隆根據內部熒光強度排名,并設門分為四個熒光組:高、中、CHO-K1陰性和ungated(圖2). CHO-K1陰性組被定義為背景熒光信號。所有的克隆識別對應于陰性對照孔。Ungated克隆是指低熒光信號但高于背景熒光信號的克隆。
直接標記抗體和雙抗體的方法(圖3)顯示了陽性樣品(表達M1)的熒光信號和無熒光信號的親本細胞系(圖4)。正如預期,由于一抗和二抗結合,雙抗體的方法在PE通道產生了更高的背景信號。然而ClonePix2在明場檢測細胞,然后再看細胞克隆內的熒光信號。在PE通道中識別到但在明場識別不到的物體不被當做是克隆。因此,ClonePix2系統好處是具有從背景信號中區分真實克隆的能力。
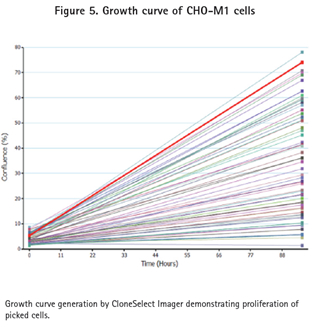
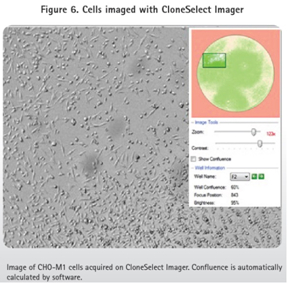
ClonePix2系統挑取的克隆CHO-M1儲存到含200μL Ham’s F12 media+10%FBS+G418的96孔Greiner板,而CHO-K1克隆儲存到同樣的微孔板但不包括G418。這些96孔板在CloneSelect Imager系統中成像確認細胞的轉移和生長(圖5)。細胞培養一周后再使用CloneSelect Imager分析確保細胞已經增殖(圖5和6)。細胞隨后轉移到384孔板,用FLIPR Tetra系統和鈣6試劑進行功能確認。
FLIPR Tetra系統驗證ClonePix2挑取細胞的M1 GPCR表達
細胞準備
ClonePix2系統挑取的細胞種到384孔,每孔25μL培養基,5,000個細胞,37℃,95%濕度和5%CO2過夜培養。這些細胞分選為四個組:高、中、低和no M1表達。
加入鈣敏感熒光染料
從培養箱中取出細胞培養板,室溫平衡。25μL的FLIPR Calcium 6 染料直接加入含培養基的細胞板。這些板孔中加入2.5Mm的丙磺舒阻止有機離子轉運,37℃孵育2小時。室溫保持直到熒光讀數。
FLIPR Tetra 熒光成像讀板儀
孵育和室溫平衡后,放一塊板到FLIPR系統中,FLIPR系統ICCD相機捕獲熒光鈣信號,成像參數如下:
曝光(sec) 0.53
激發LED(nm) 470-495
發射濾光片(nm) 515-575
LED 強度(%) 80%
FLIPR 鈣6 試劑盒
每秒熒光讀數,分別在加Carbachol之前讀10個點,加40nm的Carbachol之后讀60點。Carbachol的起始濃度是終濃度的5倍。Carbachol的加入體積是12.5μL ,分液速度是20μL/sec.
FLIPR Calcium 6試劑盒驗證挑好的CHO-M1和CHO-K1細胞克隆
膜結合G蛋白偶聯毒草堿受體表達水平用標記PE的抗M1最新傳代細胞和初始的CHO-M1細胞,預期的結果是初始的CHO-M1細胞M1 GPCR的表達水平將大大低于最新傳代的細胞。親本的CHO-K1細胞作為陰性對照。
受配體GPCR的激活,受體構象的改變觸發胞內G蛋白的激活。活化的G蛋白具有誘導胞內的不同信使包括鈣信使的潛能。
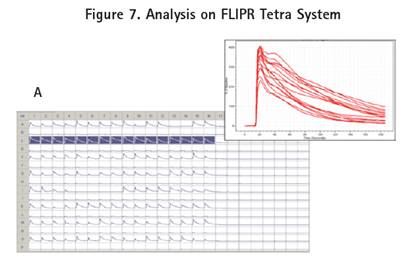
ClonePix2系統挑取的不同組細胞用FLIPR Tetra系統來評價功能活性。在40nM的Carbachol條件下,鈣敏感熒光染料(FLIPR Calcium 6 Assays kit, Molecular Devices)用來評估胞漿中鈣離子隨著激活的G蛋白偶聯IP3敏感通路的變化而變化的可行性研究。歷史數據表明,40nM Carbachol 是 EC80的濃度。
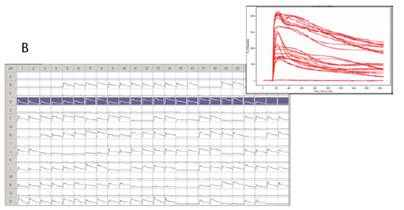
在高熒光的CHO-M1細胞克隆中,相對背景,Carbachol產生了增加4倍的熒光讀數(圖7A)。在混合中和低熒光的CHO-M1細胞克隆中,Carbachol分別產生了4倍到2倍的熒光讀數增加(圖7B)。最后陰性對照的CHO-K1細胞,Carbachol沒有引起熒光讀數的任何變化(圖7C)。由于每組細胞,除了中和低表達熒光的混合細胞,是分別種在不同的384孔板中,在加入40nM的Carbachol之前,每孔基線熒光強度的變化都進行了背景熒光的均一化。
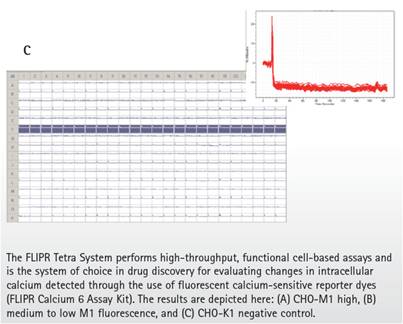
這些結果支持了在膜結合G蛋白偶聯毒草堿受體表達水平和功能活性之間的正相關性。缺乏熒光信號的CHO-K1細胞陰性對照進一步確認了ClonePix2系統能準確區分表面表達M1 GPCR 的細胞和表面沒有表達M1 GPCR的細胞。
總結
為了滿足高通量篩選和選擇性需求分析,GPCR轉染細胞系是細胞功能試驗強有力、獨特和規范的研究平臺。本文的結論是初步的研究揭示了ClonePix2系統能可靠地檢測GPCR不同表達水平的細胞克隆。而且,熒光強度和FLIPR Tetra系統測定的GPCR介導的胞漿內鈣離子水平的變化呈現正關聯,這些鈣離子的變化恰恰膜結合G蛋白偶聯毒草堿受體M1表達差異導致的。
ClonePix2系統能夠有效用于檢測和挑取不同GPCR表達水平的細胞克隆,因此為需要高質量GPCR蛋白的各種應用提供了唯一的資源,這些應用包括(1)使用高表達天然表位的抗原生產相應的抗體;(2)表達GPCRs困難的特殊GPCR家族的細胞功能分析。