質譜流式技術——蛋白水平的單細胞技術
摘要:
在蛋白質水平,流式一直是最為常用的單細胞分析手段。但是由于串色等問題的困擾,流式通常只能進行6~10種蛋白的同時檢測。質譜流式技術的出現給研究者帶來了驚喜。利用分辨力超強的質譜技術以及獨特的金屬標記抗體,CyTOF2質譜流式細胞儀在檢測通道數量和信號質量兩方面都有了質的提升。
單細胞技術在近年來的發展迅速,隨著單細胞測序、單細胞轉錄組等技術的不斷發展,人類從DNA、RNA的水平深入了解了細胞群體異質性。在蛋白質水平,流式一直是最為常用的單細胞分析手段。但是由于串色等問題的困擾,流式通常只能進行6~10種蛋白的同時檢測。
質譜流式技術的出現給研究者帶來了驚喜。利用分辨力超強的質譜技術以及獨特的金屬標記抗體,CyTOF2質譜流式細胞儀在檢測通道數量和信號質量兩方面都有了質的提升。
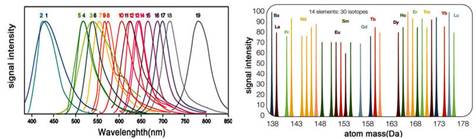
圖1. 相對于傳統流式(左),質譜流式信號(右)具有更多的通道和更好的信號分辨力
相比傳統流式,質譜流式具有以下優勢:
第一、通道數量增加到上百個
質譜流式細胞儀中的ICP質譜裝置具有非常寬的原子量檢測范圍(88~210Da),因此可以同時檢測上百個不同的參數。
第二、通道間無干擾,無需計算補償
ICP質譜具有超高的分辨能力,可以完全區分開用來標記的各種元素(如右圖所示)。這樣不僅使實驗流程得到簡化,也節約了標本和試劑。
第三、采用獨特的金屬標簽抗體,背景極低
采用新概念的金屬標簽抗體,金屬離子通過多聚螯和物共價的結合在抗體的不變區。由于細胞本身不含這些作為標簽的金屬元素,所以沒有傳統流式的“自發熒光”,信號背景極低。

應用實例:Discover more, Imagine more.
龐大的檢測通道數量,賦予質譜流式技術前所未有的數據獲取能力,它可以使研究者從有限的樣品中得到更多的科學信息。
(一)對骨髓細胞的分析
斯坦福大學Nolan實驗室,利用31通道的檢測對骨髓樣品進行分析。整個細胞群體被分為分成約30個亞群,并對各群細胞中的18個信號通路分子進行分析。

圖2. To read cells' minds——質譜流式可以對骨髓細胞進行的細致分類和信號通路分析
(2)T細胞成熟過程分析
更重要的,結合生物信息學對質譜流式數據進行數據挖掘,可以使我們了解到更多生命過程的細節以及細胞群體的異質性。例如,通過對T細胞25個表面、功能標志物的表達數據進行處理,可以直接分析出T細胞從原始的Naive T細胞到效應T細胞的整個成熟過程。

圖3. 質譜流式對T細胞成熟過程的分析
(3)藥物篩選
另外,由于標簽種類豐富,該技術還可以廣泛的應用到各種篩選實驗中,例如抗原決定簇的篩選、藥物篩選等。也正是由于其強大的數據獲取能力,它甚至可以成為單細胞蛋白質組學研究的得力工具。

圖4. Nature子刊封面文章,通過高通量的流式分析進行藥物篩選





