實時熒光定量PCR簡介
熒光定量PCR檢測技術從誕生到現在已經有 8 年了,但是其應用在近四年才迅猛增長。在 Medline 數據庫中,用“ Taqman” 或 ”real time PCR” 作為關鍵詞檢索,在1996 年僅有 19 篇,在 1997 年僅有 28 篇,在 98 、 99 、2000 年分別達到了 52 、 157 、 409 篇, 2003 年已經達到2984 篇,相信在不久的將來會有更多的文章發表。針對實時 PCR 這一熱點領域,閃晶公司對它進行了深入細致的研究,并且及時地為廣大科研人員推出這項技術服務。 
熒光定量PCR基本原理
• Taqman 技術:該技術以美國 ABI 公司為代表。 PCR 擴增時,在加入一對引物的同時加入一個特異性的熒光探針。該探針為一直線型的寡核苷酸,兩端分別標記一個熒光報告基團和一個熒光淬滅基團,探針完整時,報告基團發射的熒光信號被淬滅基團吸收, PCR 儀檢測不到熒光信號; PCR 擴增時(在延伸階段), Taq 酶的 5' - 3' 外切酶活性將探針酶切降解,使報告熒光基團和淬滅熒光基團分離,從而熒光監測系統可接收到熒光信號,即每擴增一條 DNA 鏈,就有一個熒光分子形成,實現了熒光信號的累積與 PCR 產物形成完全同步,這也是定量的基礎所在。 
• Beacon 技術:該技術以美國人 Tagyi 為代表。也是加入了熒光探針,但它是 環狀的寡核苷酸探針,分別由莖部和環部組成, 兩端分別標記 熒光報告基團和熒光猝滅基團,在無靶序列的情況下,探針始終是環狀,報告基團的熒光被猝滅基團猝滅,使熒光檢測儀檢測不到熒光信號;而在有靶序列時,即在 PCR 的退火階段探針與靶序列結合,使熒光報告基團和猝滅基團分開,這樣熒光儀可以檢測到熒光,熒光信號的強弱代表了靶序列的多少。

• FRET 技術:該技術以 Roche( 羅氏公司 ) 為代表。它的基本原理是:兩條直線型寡核苷酸探針,其中一條的 3 ‘端標記熒光激發基團,另一條的 5 ' 端標記熒光檢測基團,在無靶序列的情況下,兩條探針分開,無法進行能量的傳遞,這樣熒光儀不能檢測到熒光信號;而當有靶序列時,即在 PCR 的退火階段兩條探針與靶序列結合,使得兩條探針上的熒光基團可以進行能量的傳遞,這樣熒光儀就可以檢測到熒光信號,熒光信號的強弱代表了靶序列的多少。 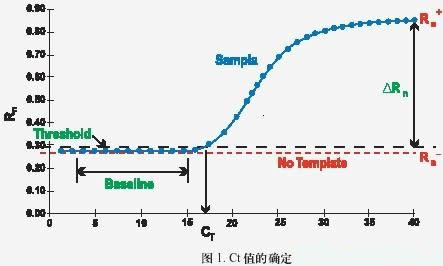
• Ct 值:是指每個反應管內的熒光信號到達設定的域值時所經歷的循環數(如下圖所示)。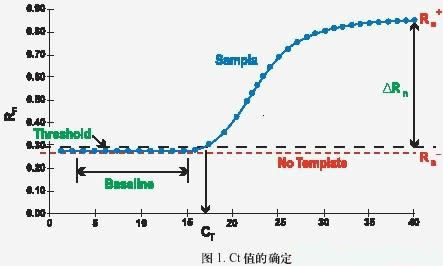
• 熒光域值( threshold ):是指 PCR 反應的前 15 個循環的熒光信號,熒光域值的缺省設置是 3-15 個循環的熒光信號的標準偏差的 10 倍,即:threshold。
• Ct 值與起始模板的關系:研究表明,每個模板的 Ct 值與該模板的起始拷貝數的對數存在線性關系〔 1 〕,起始拷貝數越多, Ct 值越小。利用已知起始拷貝數的標準品可作出標準曲線,其中橫坐標代表起始拷貝數的對數,縱坐標代 Ct 值(如圖 2 所示)。
因此,只要獲得未知樣品的 Ct 值,即可從標準曲線上計算出該樣品的起始拷貝數。
熒光定量PCR應用廣泛
• 可以對各種基因的表達進行定量分析,如:同一基因在不同組織中的表達差異、同一基因在不同藥物處理后的表達差異、轉基因食品的檢測。過去最常用的高通量篩選基因表達差異的技術是 cDNA 芯片和差異顯示,但這兩種技術的缺點是只能定性而非完整意義上的定量分析。實時 PCR 技術和高通道實時 PCR 儀的出現,無疑為這種檢測提供了極大的方便。
• 可以進行點突變分析和等位基因分析,用不同的熒光報告基團標記 Taqman 探針,然后分別與野生型和突變型雜交,如果一種熒光信號明顯強于另一種熒光信號,則表明它是純合子;如果兩種熒光信號都明顯增強,則表明它是雜合子。另外分子信標( Molecular Beacon )就是專門為這種技術設計的探針。
• 可以進行單核苷酸多態性的分析,檢測單核苷酸多態性對于研究個體對不同疾病的易感性或者個體對特定藥物的不同反應有著重要的意義,因分子信標結構的巧妙性,一旦 SNP 的序列信息是已知的,采用這種技術進行高通量的 SNP 檢測將會變得簡單而準確。
• 可以進行 DNA 甲基化檢測, DNA 甲基化同人類的許多疾病有關,特別是癌癥, Laird 報道了一種稱作 Methylight 的技術,在擴增之前先處理 DNA ,使得未甲基化的胞嘧啶變成尿嘧啶,而甲基化的胞嘧啶不受影響,用特異性的引物和 Taqman 探針來區分甲基化和非甲基化的 DNA ,這種方法不僅方便而且靈敏度更高。
• 對傳染性疾病進行定量定性分析,這在我國應用比較廣泛,大家比較熟悉。許多生產臨床 PCR 試劑的廠商已經陸續推出了一系列的診斷試劑,如:肝炎系列、性病系列、腫瘤系列等等。





