選擇性微電極在植物生理學研究中的應用
1北京林業大學生物科學與技術學院,北京100083;2旭月(北京)科技有限公司,北京100080;
3Vibrating Probe Facility,Biology Department,University of Massachusetts at Amherst,MA 01003,USA
摘要:選擇性微電極技術是一種不僅能直接測定活的生物細胞或細胞器內的離子或分子活度,而且能對活的生物相鄰的位置、功能和代謝速率可能不同的特定微區細胞表面的離子或分子流(flux)分別測定的電生理方法。具有操作簡便、實時、非入侵性(測定移動速率時)、靈敏度高(可達10-12molescm-2s-1)等優點。因為它是用微型化(尖端直徑為0.5~53 μm)的離子或分子選擇性電極直接對準樣品測定,不同于其它化學測定需取樣品,所以能連續測定和自動監測,具有廣闊的應用前景。該文闡述了選擇性微電極測定原理,總結了選擇性微電極技術在植物生理學研究中的應用進展,并展望了其發展前景。
關鍵詞:離子或分子流;離子或分子活度;選擇性微電極技術;植物
中圖分類號:Q945
植物在生長發育過程中,不斷從環境中吸收水分和攝取各種礦質元素,并進行O2和CO2等氣體交換。研究人員通常是以植物的器官或組織作為研究對象,來了解礦質元素、O2和CO2等在植物生命過程中的運輸方式、作用機理。隨著各種微電極的發展,應用微電極對單個細胞或完整植株特定微區細胞進行研究已經成為可能。
離子/分子選擇性微電極是一種連接了電位計或電流計后,可以對溶液中某些特定離子/分子活度給出電位/電流指示的電極。構成微電極的材料,已從傳統的玻璃發展到金屬、高分子聚合物、碳絲、光纖及其它納米材料。20世紀50年代以來,隨著離子選擇性微電極的出現和發展(Hinke 1959;Berman和Hebert 1974;Sykoνά等 1981),離子選擇性微電極也開始被用來研究植物(Bowling 1972)。80年代后,選擇性微電極技術發展較快,在動物和人體上研究較多,近年來在植物上的研究報告越來越多,有測定生物體液泡(Walker等 1995)和細胞質(Carden等 2001)中離子的活度的微電極技術(Carden等 2003);基于離子/分子選擇性微電極技術發展而來的技術,即“非損傷微測技術”包括如下技術:1)自參比技術(Self-Referencing Technolog)(Kühtreiber和Jaffe 1990); 2)生物體表面離子信息的微電極離子流測定(microelectrode ion flux measurement,MIFE)技術(Newman等 1987;Shabala 2000;Newman 2001;Shabala等 2005);3)掃描離子選擇電極技術(scanning ion-selective electrode technique, SIET)(Kunkel等 2001;Kunkel等 2005;Vincent等 2005;Xu等 2006)和 4);還有用于測定生物體表面分子信息的掃描極譜電極技術(scanning polarographic electrode technique,SPET)(Kunkel等 2005;Xu等 2006);因此微電極技術的最大特點在于,它能準確地測定單個細胞或完整植株特定微區細胞內外離子或分子的活度與流動,被用于研究植物對離子或分子吸收、釋放及跨膜運輸的機制。它具有操作簡便、實時、靈敏度高、非損傷性等特點,而且還可以在電腦控制下連續測定與自動監測,實現了生物體內外離子或分子信息的同時進行的實時測定(Kunkel等 2005;Xu等 2006)。
1 選擇性微電極的工作原理
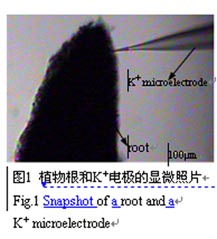
植物細胞內的離子或分子進出細胞時,在細胞的內外之間會形成一個跨膜的電化學勢梯度(Δψm)。當離子選擇微電極置于細胞或組織表面時(圖1),微電極可以對溶液的離子濃度做出響應,由于細胞可以吸收或釋放離子或分子,與細胞或組織表面離子或分子的濃度存在著濃度梯度,因此,會產生離子或分子的擴散性移動,傳感器產生的信號經放大器的放大輸出到計算機,就可以實時地檢測到細胞或組織表面離子或分子流動的變化。計算離子或分子的移動速率,離子擴散是可依據Fick第一定律進行計算(Kühtreiber和Jaffe 1990;Xu等 2006),也可依據能斯特(Nernst)方程(Newman 2001)計算。
1.1 依據Fick定律推導離子移動速率
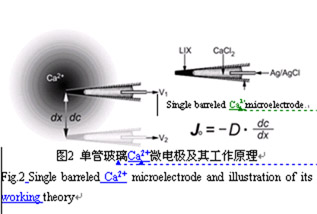
離子選擇性微電極在待測離子濃度梯度中對已知的兩點的距離(dx)進行測定,分別獲得電壓V1和V2(圖2)。兩點間的濃度差(dc)從V1、V2及已知的該電極的電壓/濃度校正曲線計算就可以獲得。D是離子或分子特異的擴散系數(單位:cm-2s-1),將它們代入Fick的第一擴散定律公式:
Jo =-D·dc/dx,可獲得該離子的移動速率(Jo,單位為moles·cm-2·s-1)。
1.2 依據能斯特方程推導離子移動速率
在測定開始時,微電極的尖端位于被測試材料距離x的位置,在距離x處,溶液中離子的電化學勢為μ(J/mol)。根據離子的自由濃度c和電勢Vb,μ可以根據如下公式計算:
μ=μo+RT㏑γc+zFVb ,式中μo為電化學勢參考值,z為離子化合價數,γ為離子在溶液中的活動系數,F為法拉第常數(96500 C/mol),R為氣體常數(8.3 J mol-1K-1),T為熱力學溫度(K)。當離子選擇微電極的尖端緩慢移動(不攪動溶液)一段距離(dx)時,新位置處的電化學勢為μ+dμ,此處的dμ為新位置處的濃度c與電勢Vb的變化值,而電化學勢參考值μo不變。標準電化學理論認為,根據離子濃度c(mol/m)、離子的運動速度u(m s-1mol-1newton-1)以及電化學勢梯度(dμ/dx),就能計算出離子的凈流量J(mol m-2s-1):
J=cu(dμ/dx)。在電極的內部,離子濃度是固定的,因此dμ就表示為內部電壓(V)的變化即dV,理想狀態下dμ= zFdV。V可以用靜電計測定,當電極移動一段距離dx時,靜電計測定值為dV。對于某一特定離子,u為已知的常數。因為LIX并不總是表現為理想的Nernst行為,實際測定的內部dV通過一個因子g(約接近1.1)降低外部的dμ。因為這個原因,需要把外部dμ與內部測定的dV聯系起來,公式應為dμ= zFgdV。因此離子的凈流量J就可由如下公式計算:
J=cu zFg(dV /dx)。
雖然Newman(2001)是根據溶液中離子的電化學勢(μ)來推導離子的移動速率。但是生物材料實驗證明,離子選擇性微電極的移動距離(dx)在幾十微米以下時,帶電粒子運動對電化學電勢的影響可以忽略不計,所以離子的移動速率也可以通過Fick第一擴散定律計算出來。
應用選擇性微電極進行植物研究的早期工作主要是測定細胞內離子活度(Bowling 1972),隨著三維微操縱技術和電腦軟件控制技術的發展,選擇性微電極技術也得到了快速發展,現在不僅能測定細胞內離子活度(Walker等 1995;Carden等 2003),而且還能測定到活體植物體器官、組織、甚至細胞表面微量離子以及分子移動的速率。
2 在植物營養運輸研究中的應用
選擇性微電極的出現不僅為研究者提供了快速、靈敏地獲得活體植物營養運輸信息的途徑,而且還能用來獲得微小區域不同離子微量的信息。Henriksen和Spanswick(1993)采用NO3-微電極研究大麥根對NO3-的吸收情況時,發現只有用NO3-的預處理才能誘導從0.1 mmol/L的Ca(NO3)2中對NO3-的吸收。當有NH4+和NO3-在一起時,與無NH4+的相比,大麥根對NO3-的吸收減少,而對NH4+的吸收則不受影響(Henriksen等 1990)。對于NO3-和NH4+同時供給玉米根 (0~3.5 mm)時,NH4+的凈吸收比NO3-的凈吸收高2倍。當有100 μmol·L-1的NH4+時,玉米分生區對NO3-的吸收急劇下降,而且在其他區域下降幅度更大,這說明NH4+的存在會抑制NO3-的吸收(Taylor和Bloom 1998)。Colmer和Blomm(1998)用NO3-、NH4+微電極考查水稻不定根對NO3-和NH4+的吸收情況時,發現NO3-和NH4+在成熟區、分生區與伸長區的吸收之間有差異,距根尖端的1 mm區域對NO3-和NH4+的吸收速率都大,NH4+的吸收速率高于NO3-的吸收速率;相反,在含有厚壁組織纖維的水稻不定根的基部區域(距根尖端21 mm之外),NO3-和NH4+的吸收速率明顯較低,因此作者認為厚壁組織的纖維限制了根對NO3-和NH4+的吸收。同樣,我們實驗室用H+、K+微電極研究沙冬青的幼根不同區域在鹽脅迫下H+和K+的進出速率情況時,發現其根冠(0~500 μm)和分生區(500~2500 μm)H+、K+的外流量也都較基部(大于2.5 mm之外)大得多。選擇性微電極測定得到的結果可以說明,根冠和分生區是吸收營養元素的關鍵部位。
植物體內硝酸鹽營養可明顯改善植株的生長發育。我國學者用NO3-微電極測定了小白菜、水稻活體細胞中NO3-的活度(賈莉君等 2005a,b;尹曉明等 2005),因此,NO3-微電極的使用可以為選育氮素高效吸收的植物品種提供電生理指標。
鉀是大多數植物活動細胞中含量最高的無機元素,鉀在碳水化合物代謝、呼吸作用及蛋白質代謝中起重要作用。另外,鉀離子還是調節細胞滲透勢、平衡膜電位的最重要組分。鉀離子進入還是逸出植物根系表面與外界環境中鉀離子的濃度有關。當植物根尖處于低鉀(<10 μmol/L)溶液中時,用K+微電極可測到K+會從根的分生區和伸長區流出,從而使所處溶液中的K+濃度到50 μmol/L(Newman等 1987;Ryan等 1990,1992)。Ryan等(1992)用Cl-微電極研究小麥對鋁敏感和耐鋁品種根內Cl-的流動時,觀察到在小麥根處于0.1 mmol/L的CaC12(pH4.5)介質中時,Cl-大量地從分生區流人介質中。
以上研究結果充分表明,選擇性微電極這種能直接并靈敏地反映植物體特定微區(>um)對礦質元素的需求的測試工具,一方面可供研究者進行某種離子高或低吸收的植物品種篩選,另一方面可供研究者制定出與植物需求相適應的環境營養水平。
3 在植物生長發育研究中的應用
光通過光周期和非光周期過程影響著葉片的展開。選擇性微電極能探測到光誘導引起的與葉片生長有關的離子或分子信息。Zivanovic等(2005)利用選擇性微電極比較了白光(2600 μmol·m-2·s-1)下及結合使用DCMU后的玉米葉片不同區域(葉基部和葉頂部)的H+、K+和Ca2+流量,結果表明,去表皮葉片的葉基部和葉頂部離子流量無顯著差異,留表皮的葉片的葉基部和葉頂部離子流量有顯著差異,并推測,光誘導引起的葉表皮K+流(動)是葉片展開必需的,葉肉細胞K+流的變化可能只是起著平衡電荷的作用;光誘導的Ca2+內流既不直接引起葉片展開,也不直接貢獻光合行為表現。該研究表明,選擇性微電極探測到的光引起離子流的變化既與葉片生長相聯系,也與光合作用有關。更有趣的是,Shabala和Newman(1997a)用H+、Ca2+微電極研究玉米根不同區域的回旋轉頭運動(circumnution)與H+、Ca2+的流動關系時,發現根伸長區的H+流動與玉米根的回旋轉頭運動關系密切。認為H+流的振動(oscillation)可能參與了根的回旋轉頭運動。
菌根是土壤中特有的真菌與植物根的共生聯合體。植物有了菌根,就可以通過無數細長菌絲和菌索吸收土壤中的營養和水分,擴大根系的吸收面積,提高吸收能力。選擇性微電極可直接置于植物活的外生菌根(ectomycorrhizae)表面,研究單個菌根對不同離子吸收或釋放的情況(Plassard等 2002)。這為在含有不同離子的土壤上種植喜好該土壤中離子的菌根植物,提供了一種方便快捷的方法。由此看來,微電極技術還可以用來研究不同生活習性的植物根系對離子吸收的嗜好,為不同植物種植于不同離子含量的土壤中提供理論依據。
近幾年,選擇性微電極技術發展較快,除了能用于測定植物體H+、K+、Na+、Ca2+、Cl-、NO3-、NH4+、Cd2+(Piñeros等 1998)、Mg2+(Shabala和Hariadi 2005)離子信息,還能測定O2信息(Xu等 2006;Pang等 2006;Shabala等 2006)。如,Xu等(2006)利用H+微電極和O2極譜電極同時測定了百合花粉管生長過程中H+和O2進出的變化。結果表明,在花粉管堿化區域的H+表現為外流,而O2表現為內流,因此,推測花粉管堿化區域有豐富的活躍的線粒體。
上述研究結果充分說明,選擇性微電極技術能單獨地用來有效測定植物生長發育過程中所需的各種礦質元素、H+、O2等的含量和它們之間的關系,這對人們研究植物根系的生長及其對土壤中各種營養元素的吸收過程提供了一個極為有效的手段。
4 在植物信號轉導研究中的應用
Ca2+是植物活細胞信號轉導過程的重要第二信使,通過許多種依賴鈣的調節蛋白和功能蛋白,鈣信使幾乎在植物細胞的所有信號轉導途徑中發揮著重要作用。觸摸、病原物侵染、植物激素、逆境(包括鹽脅迫、氧化脅迫、低溫、高溫、干旱等)均能引起胞內Ca2+水平改變。這種變化通過啟動胞內生理生化過程,起著傳遞和放大信號的作用(Bush 1995)。
Bjorkman和Cleland(1991)采用Ca2+微電極測定玉米根尖表面Ca2+的流(動),發現在受重力刺激的根尖內外存在一個Ca2+梯度。該Ca2+梯度似乎具有信號傳遞功能。隨著Ca2+微電極技術的不斷應用,人們發現Ca2+流(動)還涉及到植物對各種環境脅迫的反應。如,Huang等(1992)認為Al3+能抑制對Al3+敏感小麥品種對Ca2+的吸收,而不抑制耐Al3+小麥品種對Ca2+的吸收。Halperin等(1997)發現在鹽脅迫下大麥根尖對Ca2+的吸收下降,而其他區域則不下降。Vincent等(2005)比較了野生型和突變體擬南芥根毛外部Ca2+的流(動)情況,發現缺失AtSfh1p的根毛的Ca2+信號傳遞異常。Felle等(2000)利用Ca2+和H+微電極考查(GlcNAc)n和Nod factors對苜蓿(Medicago sativa subsp. sativa cv Sitel)根毛細胞內Ca2+和H+活度的變化及細胞防御反應的關系時,發現(GlcNAc)n和Nod factors與根毛共生及防御相關的信號感受位點不同,而且由它們引起的胞內Ca2+活性或者pH的變化及其下游響應也不一樣。
Shabala和Newman(1997b)用H+微電極測定了對驟冷敏感的黃瓜、南瓜,不敏感的豌豆,蠶豆及中度敏感的玉米等5種作物根表面H+的運輸情況,觀察到經過4℃冰箱冷脅迫處理1.5 hr的植物根系表面的H+,開始幾分鐘都表現為外流,只是耐冷的豌豆和蠶豆的H+外流持續時間短些(3~4 min),而冷敏感的黃瓜和南瓜的H+外流持續時間長(8~12 min),而且耐冷的豌豆和蠶豆的ACT1(associated with H+ minimum)和ACT2(associated with H+ maximum)顯著的低于冷敏感的黃瓜和南瓜的。并認為離子流(動)的進一步研究也許能指明胞內感受驟冷脅迫的位點及其信號傳導途徑。
Hanstein和Felle(2002)用Cl-微電極研究觀察了CO2對蠶豆保衛細胞及其質外體中的Cl-活性。結果表明,CO2濃度從350 μl/L增至600 μl/L時,質外體的Cl-活性在10 min內就從3 mmol·L-1增加到14 mmol/L,這表明大量Cl-從保衛細胞流出。這種Cl-反應與關閉光源所引起的Cl-外流相似。CO2引起的Cl-外流暗示有一個來源于CO2的中間效應器,它能激活保衛細胞原生質膜上的陰離子通道,從而引起Cl-外流。Tegg等(2005)利用非損傷離子流測定技術探測到了植物組織(根、花粉管)因使用thaxtomin A(一種植物毒素)而引起的Ca2+和H+流量變化,并認為具有組織特異性的Ca2+、H+流量的快速變化,是thaxtomin A引發的早期信號,是植物感知病原體的關鍵方式。
上述結果說明,超靈敏的選擇性微電極可以應用于離子的極微量變化的信號探測。
5 在植物逆境生理研究中的應用
隨著選擇性微電極技術的日益成熟,近年來,許多學者開始用選擇性微電極探討植物適應逆境的離子或分子流的瞬間變化(我們稱之為原初響應機制)。Shabala(2000)考察了蠶豆葉片葉肉細胞在鹽脅迫和滲透脅迫下離子流的響應機制,觀察到90mM NaCl會導致K+出現明顯的外流,促進H+泵活性,但是當測定液中含有10mM Ca2+時,上述現象就不發生。然而Na+流無論在高Ca2+或低Ca2+的測定液中,變化都不明顯。相反地是,蠶豆葉片在150mM 甘露醇(相當于-0.38 MPa)下,K+出現明顯的內流。因此,Shabala認為蠶豆葉參與感知鹽分和滲透脅迫的離子響應機制是不同的。而且他們還發現,所處測定液的離子組成的變化并不會改變滲透脅迫(150mM 甘露醇)引起葉肉細胞K+、Cl-顯著的增加(Shabala等,2000)。另外,shabala等(2002)把選擇性微電極技術和壓力探針技術結合起來,直接觀察到了滲透脅迫時擬南芥根表皮細胞膨壓變化與離子移動之間的關系,實時地證明了滲透脅迫一開始,細胞膨壓立即從0.65 MPa降低到大約0.25 MPa。當脅迫2~10 min左右時,細胞膨壓開始恢復,而且此時伴隨著K+、Na+、Cl-的顯著內流(30~80 nmolm-2s-1),并認為細胞膨壓的快速恢復主要是由于滲透脅迫引起大量K+、Na+、Cl-調入細胞,從而加大吸水能力。
Carden等(2003)在測定200 mmol/LNaCl脅迫下小麥根內Na+、K+、H+活度的變化時,將微電極分別插入根皮層細胞的胞質里和液泡里,測定了這兩部分Na+等離子在200 mmol/LNaCl脅迫下第5、8天發生的變化。結果表明,NaC1脅迫處理后的第5天,大麥耐鹽品種‘Gerbel’和鹽敏感品種‘Triumph’根皮層細胞胞質都具有較高K+活度,而細胞胞質中的Na+活度則是鹽敏感品種明顯高于前者;NaC1脅迫處理第8天,耐鹽品種根細胞胞質仍能維持高K+活度,而鹽敏感品種的K+活度下降,Na+活度則‘Gerbel’細胞胞質中高于‘Triumph’。Pang等(2006)用選擇性微電極研究了耐澇大麥與澇敏大麥在水澇(即氧不足)條件下,大麥根三個區域表面的H+、K+、O2流(動)。發現澇敏大麥‘Naso Nijo’在氧不足時,其根成熟區表面的K+內流量急劇變小,而耐澇大麥‘TX9425’K+內流量幾乎未發生變化。
當用選擇性微電極進行長時間監測時,還可以觀察到植物體的離子或分子流呈現一定的次晝夜節律性波動變化。Shabala等(2006)用H+、K+、Ca2+、O2微電極分別考查了多種植物及同一植物不同部分(燕麥胚芽鞘原生質體、番茄花粉管、原生生物細胞、玉米幼根分生區、玉米葉表皮)的H+、K+、Ca2+、O2流(動)。觀察到H+、K+、O2流(動)具有內生的波動節律性變化,Ca2+流(動)卻沒有波動,而且H+、K+、O2流次晝夜節律性波動的周期會隨著環境溫度、氧濃度、試驗植株生長的基液的化學組成、鹽和滲透脅迫的變化而變化;跨膜的H+流的波動周期隨著試驗植株所處的基液中K+、NaCl濃度的升高而增大,隨著環境溫度上升而減小;O2流的次晝夜節律性波動隨著環境溫度下降、氧不足而變慢。
上述研究充分說明,選擇性微電極技術可以及時準確地檢測到活體植物離子或分子信息因環境變化而引起的微量變化。因此,該技術可能成為最靈敏、最直觀、能實時反映逆境脅迫后植物的生理指標測定方法之一。
6 選擇性微電極技術的優點與局限
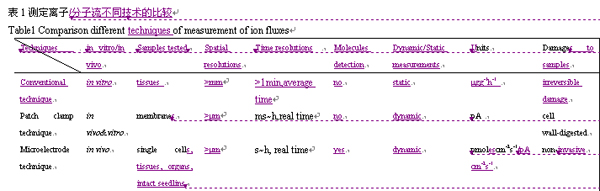
選擇性微電極技術的最大優點,是在保持被測植物樣品完整(即不造成任何損傷)和接近實際生理狀態環境下進行測定,并能實時、連續地獲得進出活體植物組織、器官、單個細胞甚至細胞器內特定離子或分子活度計移動速率。雖然膜片鉗技術也能實時監測植物生物膜離子通道的離子(電)流(ion current)變化,但是它只能用于研究脫去細胞壁后的生物膜的離子通道(電)流(許越和邱澤生 1993;朱俊英等 2006),使得它在植物上很難廣泛應用。當然,現在也有研究者把選擇性微電極技術與膜片鉗技術結合起來,同時監測生物膜的離子流(動)(ion flux)和離子(電)流(Tyerman等 2001;Gilliham等 2006),這為實時探明不同環境下生物膜離子通道、載體或泵活性的變化提供了很好的研究平臺。選擇性微電極技術與膜片鉗技術及常規技術相比具有明顯的優點,上述3種方法在測定離子流時的差異見表1。
當然,目前選擇性微電極技術也有制作困難,且不易保存,離子載體或LIX的選擇性系數不理想(Knowles和Shabala 2004),且選擇性微電極所測到的電位與溶液的濃度并不總是呈現理想的能斯特斜率(Nernstian slope),另外膨脹狀態的植物細胞及其細胞壁,容易損壞微電極的尖端(Felle 1989),因此在一定程度上也限制了其應用的范圍。
7 展望
選擇性微電極技術能用于直接并靈敏地觀察植物體對礦質元素的需求,研究者可利用選擇性微電極技術進行對植物某種離子或高或低的吸收的品種的篩選,還可制定出與植物需求相適應的環境的營養水平;能及時準確地探測到的光、溫、水澇、鹽分引起的植物體離子或分子信息的微小變化,能成為預測植物受到逆境脅迫最直觀、最靈敏的生理指標測定方法之一;超靈敏的選擇性微電極可以應用于信號傳遞過程中有關離子或分子的微量變化的信號探測;還可用于基因組后期研究所面臨的那些未知的或者人工表達的蛋白質功能的研究鑒定,等等。
近年來,在分析化學上對離子選擇電極取得了很大進展,測定下限得到了很大提高,如Ca2+等可以達到10-9 mol/L水平(Michalska 2006),以及光纖維微電極的發展(Wolfbeis 2006)、納米微粒傳感器的進展,特別是碳纖維微電極伏安法的進展為細胞生物化學物質的交換等研究產生重大影響。選擇性微電極技術在測定植物體內信號物質(如NO、H2O2、CO),磷酸鹽和Cu2+、Zn2+等微量元素也取得一些新的進展(Bakker和Qin 2006),使該方法在植物生理上的研究日益完善。
總之,由于選擇性微電極技術是非損傷性地分別記錄活體植物細胞表面的離子或分子移動的原初響應機制,能讓研究者在真正意義上實現與活體植物器官不同細胞的直接對話,能讓研究者實時了解植物體隨環境變化發生的變化及植物(細胞)所做出的反應誘發所做出的反應的原因。隨著旭月(北京)科技有限公司將“非損傷微測技術”引進到國內,選擇性微電極理論研究的深入和探測技術的不斷發展,必將更準確、更全面地揭示植物體離子、分子信息與植物特定功能之間的關系,為國內植物生理研究者揭示植物體內在的生命活動規律提供較好的技術手段。
致謝:北京林業大學尹偉倫院士對本文的熱情支持和指導。
參考文獻
Bakker E,Qin Y (2006). Electrochemical sensors. Anal Chem 78:3965-3984
Berman HJ,Hebert NC (1974). Ion-selective microelectrodes. Plenum Press,New York and London
Bjorkman T,Cleland RE (1991). The role of extracellular free-calcium gradients in gravitropic signaling in maize root. Planta 185:379-384
Bowling DFT (1972). Measurement of profiles of potassium activity and electrical potential in the intact root. Planta 108:147-151
Bush DS (1995). Calcium regulation in plant cells and its role in signalling. Annu Rev Plant Physiol Plant Mol Biol 46:95-112
Carden DE, Diamond D, Miller AJ (2001). An improved Na+-selective microelectrode for intracellular measurements in plant cells. J Exp Bot 52:1353–1359
Carden DE, Walker DJ, Flowers TJ, Miller AJ (2003). Single-cell measurements of the contributions of cytosolic Na+ and K+ to salt tolerance. Plant Physiol 131:676-683
Colmer TD, Bloom AJ (1998). A comparison of NH4+ and NO3- net fluxes along roots of rice and maize. Plant Cell Environ 21:240-246
Felle H (1989). Ca2+-selective microelectrodes and their application to plant cells and tissues. Plant Physiol 91: 1239-1242
Felle HH, Kiondoros E´, Kondorosi A´,Schultze M (2000). How alfalfa root hairs discriminate between Nod factors and oligochitin elicitors. Plant Physiol 124:1373–1380
Gilliham M, Sullivan W, Tester M,Tyerman SD (2006). Simultaneous flux and current measurement from single plant protoplasts reveals a strong link between K+ fluxes and current, but no link between Ca2+ fluxes and current. Plant J 46:134-44
Hanstein SM and Felle HH (2002). CO2-triggered chloride release from guard cells in intact fava bean leaves. kinetics of the onset of stomatal closure. Plant Physiol 130:940–950
Halperin SJ, Kochian LV, Lynch JP (1997). Salinity stress inhibits calcium loading into the xylem of excised barley (Hordeum vulgare) roots. New Phytol 135:419-427
Henriksen GH, Bloom AJ, Spanswick RM (1990). Measurement of net fluxes of ammonium and nitrate at the surface of barley roots using ion-selective microelectrodes. Plant Physiol 93:271-280
Henriksen GH,Spanswick RM (1993). Investigation of the apparent induction of nitrate uptake in barley(Hordeum vulgare L.) using NO3--selective microelectrodes: Modulation of coarse regulation of NO3- uptake by exogenous application of downstream metabolites in the NO3- assimilatory pathway. Plant Physiol 103:885-892
Hinke JAM (1959). Glass microelectrode for measuring intracellular activities of sodium and potassium. Nature
184:1257-1258
Huang JW, Shaft JE, Grunes DL, Kochian LV (1992). Aluminum effects on calcium fluxes at the root apex of aluminum tolerant and aluminum sensitive wheat cultivars. Plant Physiol 98:230-239
Jia LJ(賈莉君), Fan XR(范曉榮),Yin XM(尹曉明), Cao Y(曹云),Shen QR(沈其榮) (2005a). Remobilization of nitrate in rice leaf vacuoles measured with double-barrelled nitrate-selective microelectrodes. Sci Agric Sin (中國農業科學),38(7):1379-1385(in Chinese)
Jia LJ(賈莉君), Fan XR(范曉榮),Yin XM(尹曉明), Cao Y(曹云),Shen QR(沈其榮) (2005b). Measurement of nitrate activity in leaf cells of Chinese cabbage in vivo using double-barreled nitrate selective microelectrodes. Acta Pedolog Sin (土壤學報),42(3):447-452(in Chinese)
Knowles A, Shabala S (2004). Overcoming the problem of non-ideal liquid ion exchanger selectivity in microelectrode ion flux measurements. J Membr Biol 202:51–59
Kunkel JG, Lin LY, Xu Y(許越), Prado AMM, Feijó JA, Hwang PP. Heper PK (2001). The strategic use of good buffers to measure proton gradients about growing pollen tubes. Cell Biology of Plant and Fungal Tip Growth. IOS Press ,Amherst:81-94
Kunkel JG, S Cordeiro, Y(J) Xu(許越), AM Shipley and JA Feijo(2005) The use of non-invasive ion-selective microelectrode techniques for the study of plant development. Chapter V in Plant Electrophysiology- Theory and Methods ed. by AG Volkov, Springer-Verlag, Berlin/Heidelberg, pp 109-137.
Kühtreiber WM and Jaffe LF (1990). Detection of extracellular calcium gradients with a calcium-specific vibrating electrode. J Cell Biol 110:1565–1573
Michalska A (2006). Optimizing the analytical performance and construction of ion-selective electrodes with conducting polymer-basedion-to-electron transducers. Anal Bioanal Chem 384:391-406
Newman IA, Kochian LV, Grusak MA, Lucas WJ (1987). Fluxes of H+ and K+ in corn roots. Characterization and stoichiometries using ion-selective microelectrodes. Plant Physiol 84:1177-1184
Newman IA (2001). Ion transport in roots: measurement of fluxes using ion-selective microelectrodes to characterize transporter function. Plant Cell Environ 24:1–14
Pang JY,Newman I,Mendham N,Zhou M,Shabala S (2006). Microelectrode ion and O2 fluxes measurements reveal differential sensitivity of barley root tissues to hypoxia. Plant Cell Environ 29:1107–1121
Plassard C, Guérin-Laguette A, Véry AA, Casarin V, Thibaud JB (2002). Local measurements of nitrate and potassium fluxes along roots of maritime pine. Effects of ectomycorrhizal symbiosis. Plant Cell Environ 25:75–84
Piñeros MA, Shaff JE, Kochian LV (1998). Development, characterization, and application of a cadmium-selective microelectrode for the measurement of cadmium fluxes in roots of Thlaspi species and wheat. Plant Physiol 116: 1393–1401
Qi Q(齊瓊)(2006). Non-invasive Micro-sensing Technique – An Systematic Integration of Cutting-edge Technologies from Multiple-disciplines. Science Times (科學時報). Vol.33 May 26.
Ryan PR, Newman IA, Shields B (1990). Ion fluxes in corn roots measured by microelectrodes with ion-specific liquid membranes. J Memb Sci 53:59-69
Ryan PR, Shaft JE, Kochian LV (1992). Aluminum toxicity in roots.Correlation among ionic currents,ion fluxes,and root elongation in aluminum-sensitive and aluminu-tolerant wheat cultivars. Plant Physiol 99:1193-1200.
Shabala SN, Newman I (1997a). Proton and calcium flux oscillations in the elongation region correlate with root nutation. Physiol Plant 100:917-926
Shabala SN, Newman I (1997b). H+ flux kinetics around plant roots after short-term exposure to low temperature,identifying critical temperatures for plant chilling tolerance. Plant Cell Environ 20:1401-1410
Shabala S (2000). Ionic and osmotic components of salt stress specifically modulate net ion fluxes from bean leaf mesophyll. Plant Cell Environ 23:825-837
Shabala S, Babourina O, Newman I (2000). Ion-specific mechanisms of osmoregulation in bean mesophyll cells. J Exp Bot 51:1243-1253
Shabala SN, Lew RR (2002). Turgor regulation in osmotically stressed Arabidopsis epidermal root cells: Direct support for the role of inorganic ion uptake as revealed by concurrent flux and cell turgor measurements. Plant Physiol 129:290-299.
Shabala S, Hariadi Y (2005). Effects of magnesium availability on the activity of plasma membrane ion transporters and light-induced responses from broad bean leaf mesophyll. Planta 221:56-65
Shabala S, Shabala L, Volkenburgh EV, Newman I (2005). Effect of divalent cations on ion fluxes and leaf photochemistry in salinized barley leaves. J Exp Bot 56:1369-1378
Shabala S, Shabala L,Gradmann D,Chen Z,Newman I,Mancuso S (2006). Oscillatons in plant membrane transport:model predictions,experimental validation,and physiological implications. J Exp Bot 57:171-184
Sykoνά E, Hnίk P, Vyklický L (1981). Ion-selective microelectrodes and their use in excitable tissues. Plenum Press,New York and London.
Taylor AR, Bloom AJ (1998). Ammonium,nitrate, and proton fluxes along the maize root. Plant Cell Environ 21:1255-1263.
Tegg RS, Melian L, Wilson CR, Shabala S (2005). Plant cell growth and ion fluxe responses to the streptomycete phytotoxin thaxtomin A: calcium and hydrogen flux patterns revealed by the non-invasive MIFE technique. Plant Cell physiol 46:638-648
Tyerman SD, Beilby M, Whittington J, Justwono U, Newman I, Shabala S (2001). Oscillations in proton transport revealed from simultaneous measurements of net current and net proton fluxes from isolated root protoplasts:MIFE meets patch-clamp. Aust J Plant Physiol 28:591-604
Vincent P, Chua M, Nogue F, Fairbrother A, Mekeel H, Xu Y(許越), Allen N, Bibikova TN,Gilroy S, Bankaitis VA (2005). A Sec14p-nodulin domain phosphatidylinositol transfer protein polarizes membrane growth of Arabidopsis thaliana root hairs. J Cell Biol 168:801–812
Walker D J, Smith SJ, Miller AJ (1995). Simultaneous measurement of intracellular pH and K+ or NO3- in barley root cells using triple-barreled ion-selective microelectrodes. Plant Physiol 108: 743-751
Wolfbeis OS (2006). Fiber-optic chemical sensors and biosensors. Anal Chem 78:3859-3874
Xu Y(許越), Qiu ZS(邱澤生) (1993). Patch-clamp technique and its applications to and prospects for the studies of higher plant cells. Plant Physiol Communi (植物生理學通訊), 29(3):169~174(in Chinese)
Xu Y(許越), Sun T, Yin LP (2006). Application of non-invasive microsensing system to simultaneously measure both H+ and O2 fluxes around the pollen tube. J Integr Plant Biol 48(7):823-831
Yin XM(尹曉明), Fan XR(范曉榮), Jia LJ(賈莉君), Shen QR(沈其榮) (2005). Membrane potential changes of epidermal cells in the root tips of rice cultivars during the uptake of nitrate. Acta Pedol Sin (土壤學報),42(2):278-285(in Chinese)
Zhu JY(朱俊英),Yan H(閆慧),Yin WL(尹偉倫),Gao RF(高榮孚) (2006). Protoplasts isolation and patch clamp whole cell recording of Hippophae rhamnoides cotyledon. 2006 Doctoral forum of China(2006年全國博士生學術論壇論文集) 1250-1256(in Chinese)
Zivanovic DB,Pang J,Shabala S (2005). Light-induced transient ion flux responses from maize leaves and their association with leaf growth and photosynthesis. Plant Cell Environ 28:340-352
Application of Selective Microelectrode in Plant Physiological Research
ZHU Jun-Ying1, GAO Rong-Fu 1, XU Yue2,3*
1College of Biological Science and Biotechnology, Beijing Forestry University, Beijing 100083, China; 2Xu-Yue(Beijing)Science & Technology Company Limited, Beijing 100080; 3Vibrating Probe Facility, Biology Department, University of Massachusetts at Amherst, MA 01003, USA
Abstract: Selective microelectrode technique, known as an electrophysiological approach, can be used to measure directly specific information on ion or molecule distribution and movement both inside and outside of living organelle, biological cells, tissue and organs. It has several advantages over other methods in measuring ionic or molecular information, e.g. easy to handle, fast response, high sensitivity (10-12 molcm-2s-1) and non-invasive to the samples in addition to continuous measurement and automatic monitoring. Microscopic-scale selective electrode (with a tip diameter of 0.5~3 μm)can be used to measure net fluxes of ions or molecules outside of growing biological cells, tissues and organs, to measure both activities of ions or molecules and membrane potential inside of growing organelle and biological cells.Thus, it has many applications in various research fields.The technical principle of design and use of selective microelectrode and its progress and development prospect in plant physiological research are summarized.
Key words:ionic fluxes; molecular fluxes; ionic activity; molecular activity; selective microelectrode; plant
![]()
This work was supported by the National Natural Science Foundation of China(Nos.30371143&30571472)
*Corresponding author(E-mail: yue@xu-yue.com, Tel: 86-10-82622628)
以上文章由"旭月(北京)科技有限公司"供稿
網址:http://www.xuyue.net
電話:010-82622628、82622629
傳真:010-82622629
郵箱:pub@xu-yue.com