非損傷性掃描離子選擇電極技術及其在高等植物研究中的應用
印莉萍1 上官宇2 許越2 *
1. 首都師范大學生命科學學院, 北京 100037; 2.Younger USA Company, P.O. Box 37106, Raleigh, NC 27627 USA;)
摘要 各種分子和離子進出細胞的過程對于維持植物體自身的活性至關重要.非損傷性掃描離子選擇電極技術(Scanning Ion-selective Electrode Technique,SIET)在不接觸被測生物樣品-即在保持被測生物樣品完整和近乎實際生理環境的狀態下,獲得進出樣品的各種分子和離子的信息.該技術不僅能夠測量離子及分子靜止狀態下的絕對濃度,而且還可以測量它們進出生物樣品的運動速率及運動方向.SIET可以圍繞被測的單個或多個細胞、組織甚至器官進行靈活、方便而準確的立體測量并獲得被測物體周圍的離子或分子的三維立體數據.目前,SIET不但可以分別測量H+,Ca2+,K+,Al3+,Cd2+,Cl-和O2,CO2,NO及溫度等參數,而且可以同時采集多種離子及參數,為獲得生物樣品內外分子或離子運動的有關信息提供了良好的實驗平臺.
關鍵詞 非損傷性電生理技術 離子選擇性電極 離子跨膜轉運 SIET
對于跨膜的離子分子活性和轉運機制的研究始終是植物分子生理學研究的一個重要方面.特別是在基因組研究后期所面臨的一個挑戰就是如何理解和確認那些未知的或者人工表達的蛋白質功能,特別是細胞質膜上的離子的轉運載體,以及由這些蛋白質所產生的眾多信息是如何被細胞正確地整合到一起的.非損傷性掃描離子選擇電極技術(Scanning IonSelective Electrode Technique, SIET)作為一個綜合性較強的電生理技術成為迎接這一挑戰的理想工具.
SIET 技術的核心是離子和分子選擇性微電極(以下簡稱:離子電極)(圖1),由Kühtreiber和 Jaffe[1]設計的一套由計算機控制的自動定位測量系統演變發展而成.在計算機控制、信號放大和三維測量方面做了較大的改進[2].由于SIET能夠以非損傷的方式測量到進出生物材料的離子以及分子的運動速率,并隨著離子/分子電極種類的不斷增多以及電子線路技術和計算機硬件軟件的逐步完善,SIET逐漸被應用到基礎生物學、生理學、神經生物學、空間生物學、臨床醫學、基礎醫學、病理學、毒理學、營養分子生理學、農林學及藥物機理研究等領域[3,4].
盡管人們通過膜電壓的測量,如膜片鉗技術[5,6],及與顯微技術相結合的熒光染料技術,獲得了一些有關離子分布和運動的情況,但是,SIET技術作為對上述幾項技術的重要補充,并以其特有的時間和空間分辨率,為鑒定或驗證某些生物膜轉運系統的功能提供了非常有力的工具.在這篇綜述里,我們將介紹SIET的基本原理、方法及其在高等植物細胞研究中的應用.

(a)Ca2+微電極的顯微照片,由液體離子交換劑(LIX)和電解質組成;(b)圖中A表示通過染料標記或膜片鉗等局部研究方法的時空分辨率;B表示整體組織研究過程中通過較慢的化學痕量方法的時空分辨率;而SIET作為一個開放式的實驗平臺,較好地填補了較慢的化學痕量方法與較快的染料標記或膜片鉗等方法兩者之間的技術空白.
1 SIET 原理
1.1物理學及數學基礎
物質在液體環境中有從高濃度到低濃度擴散的趨勢.對于帶電粒子而言,還有從高電化學電勢到低的電化學電勢運動的趨勢.如果,離子電極的移動距離dx在幾十微米以下,生物材料實驗證明,影響帶電粒子運動的電化學電勢的梯度可以忽略不計,那么,該離子的擴散運動速率可以通過Fick 圖2以Ca2+濃度梯度和Ca2+微電極為例說明SIET的物理學及數學原理 離子選擇性電極由玻璃微電極、Ag/AgCl導線、電解質(100mmol/L CaCl2)及液態離子交換劑(LIX) 4部分組成.該電極在待測離子濃度梯度中以已知距離dx進行兩點測量,并分別獲得電壓V1V2.兩點間的濃度差dc則可以從V1,V2及已知的該電極的電壓/濃度校正曲線計算獲得.D是離子/分子特異的擴散常數(單位:cm-2sec-1),將它們代入Fick的第一擴散定律公式: Jo= - D * dc/dx ,可獲得該離子的移動速率(單位:pmol cm-2sec-1),即:每一秒鐘通過一個平方厘米的該離子/分子摩爾數 . 液態離子交換劑是基于大型中性分子載體的一類有機化合物.目前可以購買得到一些常見的LIX.有些研究人員根據自己的需要還自行開發特殊的LIX,其他的種類還在不斷的開發中. 1.2計算機技術及系統集成 SIET的誕生、發展與完善與計算機技術的不斷進步是密不可分的[2,8] .盡管計算機需要同時控制三維運動系統、顯微成像系統和信號放大系統3個子系統,但由于離子選擇電極相對較低的時間分辨率要求,使得普通的個人計算機也可以完全勝任.這為SIET的普及和發展提供了很好的基礎. 1.3 SIET的緩沖溶液 在使用SIET技術過程中,通常要在溶液中加入一些緩沖劑成份,如:MES,Tris或EDTA 等,用以穩定被測離子以便離子選擇電極進行測量[9-12] .然而,如果離子緩沖劑選擇或者使用不當,被測離子會與緩沖劑相互干擾,破壞被測離子的濃度梯度或者被大幅度壓縮,從而嚴重影響到SIET的應用效果.Kunkel 等通過系統的比較試驗,尋找到了一些最適合SIET 1.4 SIET測量的空間幾何構型 現有的1-2m微米直徑的離子電極,在電極距被測材料2-20 值得一提的是,SIET是目前世界上惟一能夠按照研究人員的設定,以手動或編程的方式,從任意角度(相對于被測物體表面)用離子選擇電極對被測樣品進行測量的系統.利用SIET靈活的空間測量方式的經典的例子是對植物花粉管生長過程中,尖端Ca2+內流的研究[13]. Kunkel 等發現花粉管的生長與Ca2+內流密切相關,只有在花粉管尖端迅速生長的部位才能檢測到Ca2+內流速度.已經伸長成熟的花粉管,幾乎檢測不到Ca2+內流速率.人們不但能夠測量出Ca2+的內流速率,而且還計算出該花粉管尖端一個圓盤式的結構是Ca2+進入細胞的區域(Cardenas等 1999). 2 SIET 的應用 SIET誕生和發展是在植物學研究中實現的.這可能與植物細胞外的細胞壁對膜片鉗技術來講操作較為困難有關.而利用SIET特有的非損傷性特點,可以在不對細胞、組織甚至器官造成任何損傷的情況下測知離子分子的轉運情況.正是意識到SIET的這一優勢, Kochian 等在原有的Ca2+選擇微電極的基礎上,又相繼開發出了H+,K+,Al3+和Cd2+離子選擇性電極,將其應用于玉米根和植物毒理學的研究,并為這些電極在動物研究中的應用開辟了道路[15-17].隨后,SIET技術被應用于整體根、根毛及花粉管的研究,并闡明了諸如鈣離子轉運與樣品內部活動及生長的相關性[14,18-24].Messerli等應用SIET技術將脈動式的花粉管生長所體現的周期與離子流動速率表現出的頻率相互聯系起來. [25] 2.1離子與分子流動的同時測量證明了花粉管堿化帶的存在 Hepler等發現不斷生長的百合花粉管前端存在有一個堿化帶,之后他們提出該堿化帶可能是由于區域的線粒體的密集存在所致[23].許越等應用SIET特有的雙電極同時測量功能,發現H+離子的外流和O2分子的內流是引起該堿化區的主要原因.花粉管的生長需要大量的能量,能量來源于線粒體的氧化磷酸化. O2分子的內流,伴隨H+離子的外流是形成能量的主要驅動力.也正是由于H+離子的外流造成了花粉管前端局部的堿化帶,從而證明Hepler等的假說是正確的(圖3) 圖3 (a)顯微照片顯示金屬氧電極與玻璃H+電極同時測量百合花粉管生長過程中H+離子和O2分子進出的變化;(b)在花粉管線粒體密集區域, 2.2 SIET與熒光顯微技術結合證明磷脂酰肌醇轉運蛋白與根毛發生有關 Vincent 等在鑒定出擬南芥磷脂酰肌醇轉運蛋白家族 (PITPs)的一種成份AtSfh1p 之后,將顯微熒光技術與SIET 擬南芥缺失根毛突變體(AtSfh1p)不僅在根毛形態上有變化,不規則彎曲,失去重力極性;而且在Ca2+信號傳遞方面也有異常[26]. 2.3 多離子電極的同時應用證明Ca2+及H+在植物感知重力變化中起作用 美國北卡羅來納州立大學植物系NSCORT 圖4 (a)擬南芥突變體(ARG)及其野生型擬南芥(WS);(b)ARG在重力變化刺激下的 Ca2+及H+變化與野生型對照有明顯的區別. 3 總結及展望 經過多年的改進,SIET數據的生成、采集以及校準等方面不斷得到完善.特別是應用SIET 分子生物學的進展使得我們能夠對質膜轉運載體分子加以確定、克隆和進行可控制的表達.當這些轉運載體在分子水平方面通過在酵母、卵細胞等系統中的表達予以鑒定,或者某些細胞成份的物理結構和生理功能闡明之后,SIET 致謝 感謝匡廷云院士在身患重病的情況下對SIET 參考文獻 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 23. 24. 25. 26. 27. 28. 29. 30.
第一擴散定律計算出來[7] (圖2).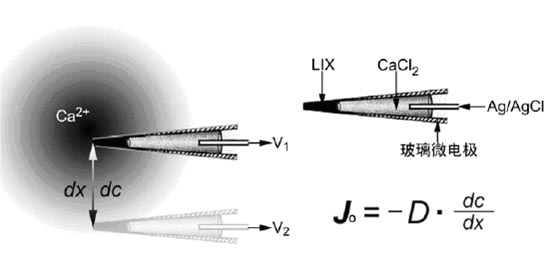
技術的溶液pH 緩沖劑及其使用方法,并以實際生物材料的研究證明通過使用這些方法可以將SIET測知離子流動速率的能力達到最大化[13].因此,在SIET
實驗設計過程中,不但要考慮到測量溶液中各種成份對被測樣品生物活性的影響,還要充分考慮到緩沖劑成份對被測離子梯度的作用以及對液態離子交換劑(LIX)有無嚴重干擾.
μm及dx在5-30μm的技術條件下,被測材料離子流動的空間幾何分布可以大致分為3類:點、平面及球體.在離子電極距被測材料小于5μm時,通常認為離子以平面方式運動.
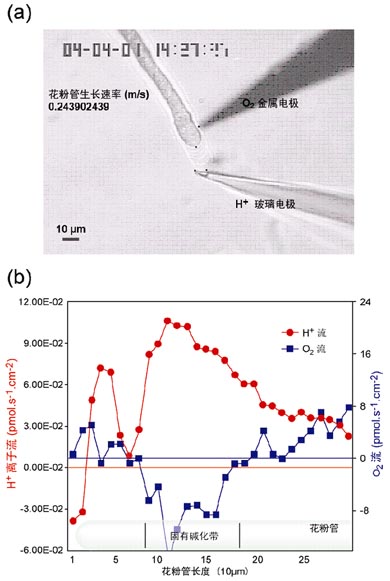
H+和O2 流動速率的同時測量.
或稱固有堿化帶區域,同時存在的H+外流和O2內流現象.
結合,從細胞的內部和外部同時證明AtSfh1p 在根毛頂端生長過程中,具有調節細胞內質膜磷酸肌醇極性運輸、Ca2+信號傳遞和細胞骨架的功能.在植物細胞的極性生長機理研究方面向前推進了一步.
利用Ca2+熒光顯微技術可測定細胞內部Ca2+濃度梯度,而利用SIET可測得外部Ca2+流動情況.結果表明野生型的根毛只有在生長旺盛的頂尖區,Ca2+的內流速度快,而突變株的根毛Ca2+流動的方向和大小明顯不同于野生型的根毛.非重力方向的根毛,四周表面都可以檢測到Ca2+的內流,而且流速高于野生型的兩倍左右. [26]
研究組受美國宇航局資助,研究植物感知重力的遺傳及生理機理,通過對重力非敏感的擬南芥突變體的研究,許越等發現植物根部在相對于地球重力不同的位置的情況下,其H+和Ca2+的流動在根部的不同位置呈現出不同的變化,顯示出及H+和Ca2+可能在植物感知重力變化的過程中扮演一定的角色(圖4)
[6].
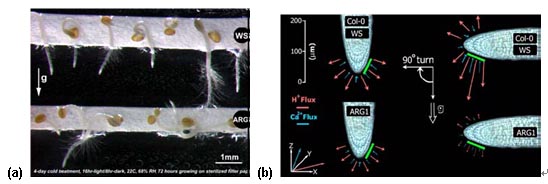
利用SIET 對重力非敏感植物突變體Ca2+及H+變化的同時測量.
強大的三維立體測量方式,研究人員可以獲得其他電生理技術無法測到的被測樣品某些點的特異活性[8,27-29]. SIET 是一個與膜片鉗[30]無論在時間分辨率還是在空間分辨率上都不相同的技術,但兩者在應用過程中可以極好地相互補充.由于SIET
技術的出現,人們對于生物體特異離子轉運系統的研究,在靈敏度上,時間和空間分辨率上已經被大大地提高了,并已成熟地與細胞和分子生物學技術、其他電生理技術和顯微熒光成像技術配合使用.SIET
技術將在主動運輸離子或分子泵和協同運輸載體的研究方面發揮重大的作用.
技術的非損傷性,多離子/分子同時測量及靈活的空間測量方式將在細胞和組織水平上的功能鑒定方面發揮重要的、甚至是無法替代的作用.
技術的關心與支持.同時感謝美國Duke大學裴真明教授所作的有益的討論.
Kuhtreiber W M and Jaffe L F. Detection of extracellular calcium gradients with a calciumspecific vibrating electrode. J. Cell Biol,1990, 110(5): 1565-1573
Shipley A M and Feijo J A. The use of the vibrating probe technique to study steady extracellular currents during pollen germination and tube growth. In Fertilization in Higher Plants -Molecular and Cytological Aspects, Springer-Verlag. 1999, 17: 235-252.
Porterfield D M, Laskin J D, Jung S-K, et al. Proteins and lipids define the diffusional field of nitric oxide. Measurement of nitric oxide fluxes from macrophages using a self-referencing electrode. Am. J. Physiol. Cell Physiol, 2001, 281(4): L904-912
Smith P J S and Trimarchi J R. Noninvasive measurement of hydrogen and potassium ion flux from single cells and epithelial structures. Am J Physiol Cell Physiol, 2001,280: C1-C11.10
Cao Z-S,Kang H-G. Zou S-B, et al. Application of Patch-clamp Technique into the Study of Cell Secretion. Progress in Biochemistry and Biophysics, 1992,19(1): 14-18
Xu Y. Introduction of the SIET. Raleigh, NC, YoungerUSA, Company. http://youngerusa. com/NY/Chinese/basics/04sanya _talk.php. [2004-06-06]
Schiefelbein J W , Shipley A M, Rowse P, et al. Calcium influx at the tip of growing root-hair cells of Arabidopsis thaliana. Planta, 1992, 187: 455-459.
Richardson D C and Richardson J S. Teaching Molecular 3-D Literacy. Biochemistry and Molecular Biology Education,2002,30: 21-26.
Pfanz H and Heber U. Buffer capacities of leaves, leaf cells, and leaf cell organelles in relation to fluxes of potentially acidic gases. Plant Physiology, 1986,81: 597-602
Pierson E S, Miller D D, Callaham D A, et al. Pollen-Tube Growth Is Coupled to the Extracellular Calcium-Ion Flux and the Intracellular Calcium Gradient - Effect of Bapta- Type Buffers and Hypertonic Media. Plant Cell, 1994,6(12): 1815-1828
Arif I, Newman I A, and Keenlyside N. Proton flux measurements from tissues in buffered solution. Plant, Cell and Environment,1995,18: 1319-1324
Demarest J R and Morgan J L M. Effect of pH buffers on proton secretion from gastric oxyntic cells measured with vibrating ion-selective microelectrodes. Biological Bulletin, 1995,189: 219-220
Kunkel J G, Lin L-Y, Heper P K,et al. The strategic use of Good buffers to measure proton gradients about growing pollen tubes. Cell Biology of Plant and Fungal Tip Growth. Amherst, IOS Press, 2001: 81-94
Cardenas L, Feijo J A, Kunkel J G , et al. Rhizobium Nod factors induce increases in intracellular free calcium and extracellular calcium influxes in bean root hairs. Plant J ,1999,19(3): 347-352
Huang J W W, Shaff J E, Grunes D L,et al.Aluminum Effects On Calcium Fluxes At the Root Apex of Aluminum-Tolerant and Aluminum-Sensitive Wheat Cultivars. Plant Physiology,1992, 98(1): 230-237
Kochian L V, Shaff J E, Kuhtreiber W M,et al. Use of an Extracellular, Ion-Selective, Vibrating Microelectrode System For the Quantification of K+, H+, and Ca2+ Fluxes in Maize Roots and Maize Suspension Cells. Planta, 1992,188(4): 601-610
Degenhardt J, Larsen P B, Howell S H,
et al. Aluminum resistance in the Arabidopsis mutant alr-104 is caused by an aluminum-induced increase in rhizosphere pH. Plant Physiology ,1998,117(1): 19-27
Miller D D, Callaha m D A, Grass D J,et al. Free Ca2+ Gradient in Growing Pollen Tubes of Lilium.Journal of Cell Science, 1992,101: 7-12
Felle H H and Hepler P K. The cytosolic Ca2+ concentration gradient of Sinapis alba root hairs as revealed by Ca2+-selective microelectrode tests and fura-dextran ratio imaging. Plant Physiology, 1997,114(1): 39-45
Holdaway-Clarke T, Feijo J A, Hackett G A, et al. Pollen tube growth and the intracellular cytosolic calcium gradient oscillate in phase while extracellular calcium influx is delayed. Plant Cell, 1997,9 (11):1999-2010.
Holdaway-Clarke T, Hackett G A, Feijo J A,et al. Oscillations of cell expansion rate, cytoplasmic calcium, and calcium influx in the pollen tube. J of General Physiology, 1998,112(1): 35A-35A
Shabala S N, Newman I A, and Morris J. Oscillations in H+ and Ca2+
ion fluxes around the elongation region of corn roots and effects of external pH. Plant Physiology, 1997,113(1): 111-118
Feijo J A, Sainhas J, Hackett G R,
et al. Growing pollen tubes possess a constitutive alkaline band in the clear zone and a growth-dependent acidic tip. Journal of Cell Biology,1999,144(3): 483-496
Newman I A. Ion transport in roots: measurement of fluxes using ion-selective microelectrodes to characterize transporter function. Plant Cell Environ, 2001,24(1): 1-14
Messerli M A and Robinson K R. Cytoplasmic acidification and current influx follow growth pulses of Lilium longiflorum pollen tubes. Plant J, 1998,16(1): 87-91
Vincent P, Chua M, Xu Y, et al. A Sec14p-nodulin domain phosphatidylinositol transfer protein polarizes membrane growth of Arabidopsis thaliana root hairs. J. Cell Biol. 2005,168(5): 801-812.
Xu Y. How does the SIET works? Raleigh, NC, YoungerUSA, Company. http://www.youngerusa.com/movies/SIET. [2004-06-06]
Pei Z M, Murata Y, Benning G, et al. Calcium channels activated by hydrogen peroxide mediate abscisic acid signalling in guard cells. Nature, 2000, 406(6797): 731-734
He Y, Tang R-H, Hao Y,
et al. Nitric Oxide Represses the Arabidopsis Floral Transition. Science,2004, 305(5692): 1968-1971
Xu, Y. and Qiu Z. Patch-Clamp Technique and Its Applications to and Prospects for the Studies of Higher Plant Cells. Plant Physiology Communications, 1993, 29(3): 169-174.
旭月(北京)科技有限公司 供稿
網址:http://www.xuyue.net
電話:010-82622628、82622629
郵箱:pub@xu-yue.com





