2025AACR年會圓滿落幕,MCE攜試劑產品亮相芝加哥

2025 年 AACR 年會于 4 月 25 日在美國芝加哥開幕,全球藥企和科研機構紛紛展示了腫瘤治療領域的最新突破。
會議即將落幕,快來隨小 M 看一看大會都有哪些研究熱點吧!
Section.01
亮相: 新藥披露
First/Best-in-class: 差異化競爭的核心
(1) RMC-5127 (HY-173629): Tri-complex RASG12V inhibitor
- 原研公司:RevMed
- 適應癥:RAS 成癮性癌癥
- 臨床狀態:臨床前 (Preclinical)
RMC-5127 是一種 First-in-class 的口服生物可利用的 RAS(ON)G12V 選擇性非共價三絡合物抑制劑。在體外可深度抑制 RAS 通路活性,抑制細胞增殖,并誘導 KRASG12V 突變型人類癌細胞凋亡。然而,其在 K/N/HRAS 野生型癌細胞中僅產生亞最大抑制,表明 RMC-5127 對 KRASG12V 的選擇性優于 K/N/HRAS 野生型。同時,反復口服 RMC-5127 在 KRASG12V 突變型 NSCLC、PDAC 和 CRC 的皮下 CDX 和 PDX 模型中,均表現出顯著且持久的抗腫瘤活性。此外,RMC-5127 在顱內腫瘤模型中表現出顯著且持久的抗腫瘤活性,在耐受性良好的劑量下腫瘤消退。在等效腫瘤暴露量下,RMC-5127 在顱內腫瘤中的抗腫瘤活性與在皮下腫瘤中的抗腫瘤活性一致。
(2) ABBV-969: STEAP1/PSMA ADC
- 原研公司:AbbVie
- 適應癥:轉移性去勢抵抗性前列腺癌 (mCRPC)
- 臨床狀態:Phase 1
ABBV-969 旨在靶向表達 STEAP1 和/或 PSMA 抗原的腫瘤細胞。前列腺癌細胞可能過度表達 STEAP1 或/且 PSMA,并且它們的表達與腫瘤的生長和存活相關。ABBV-969 目前正處于針對男性 mCRPC 的1 期臨床試驗階段。
Abbvie 披露雙靶向 STEAP1/PSMA ADC ABBV-969 攜帶滲透性 TOPi 有效載荷。報告數據顯示:ABBV-969 內化良好,在增殖試驗中比單特異性 ADC 更活躍,且細胞內有效載荷積累大約高出 2 倍。在多個 PDX 模型中均顯示出 ABBV-969 的活性。
(3) FXX489 (177Lu-NNS309): HER2-targeting RLT
- 原研公司:Novartis
- 適應癥:實體瘤
- 臨床狀態:Phase 1
諾華在手握兩款 RDC (核素偶聯藥物) Lutathera 和 Pluvicto 的基礎上持續發力,儲備了多款核藥管線。
本屆大會諾華披露了 FXX489 (177 Lu-NNS309),一種 FAP 靶向配體,具有 Best in class 的放射治療潛力。在一些相關臨床前模型 (例如 PDAC、NSCLC) 中顯示出改善的腫瘤保留率并表現出良好的抗腫瘤活性。目前正處于 Phase 1 研究 (NCT06562192),旨在評估其安全性、耐受性、劑量和初步療效。
(4) ABP-102/CT-P72: HER2 x CD3 T-Cell Engager
- 原研公司:Abpro & Celltrion
- 適應癥:HER2 過表達腫瘤
- 臨床狀態:臨床前 (Preclinical)
ABP-102/CT-P72 展現出高度選擇性的腫瘤殺傷能力。在 HER2 高表達的乳腺癌和胃癌模型中,該藥物表現出強效的細胞毒性作用,同時對 HER2 低表達細胞的活性顯著降低,規避了對正常組織造成意外損傷的風險。與基準 HER2 x CD3 雙特異性抗體 Runimotamab 的生物類似藥相比,ABP-102/CT-P72 的腫瘤抑制率最高提高了兩倍。同時 ABP-102/CT-P72 在超過親本抗體最大耐受劑量 180 倍的劑量下仍具有良好的耐受性。
難成藥相關: RAS/WRN 抑制劑
KRAS 與 WRN 等難成藥靶點靶向治療取得重要突破,聯合療法提升療效,新一代抑制劑聚焦耐藥機制,多種化學策略并行,腫瘤精準治療與藥物創新雙重加速!
(1) AMG 410 (HY-173632): Pan-KRAS inhibitor
- 原研公司:Amgen
- 適應癥:多種 KRAS 突變腫瘤
- 臨床狀態:臨床前 (Preclinical)
會議中 Amgen 公司通過介紹基于結構的多參數優化,產生對 N/H-Ras 具有選擇性的大環口服候選分子,披露了 Pan-KRAS 抑制劑 AMG410 的結構信息。
AMG 410 在 KRAS 突變細胞中顯示出強大的抗增殖活性。AMG 410 對 KRAS 具有高度特異性,對 HRAS 和 NRAS 的選擇性均超過 100 倍,通過其避免非 KRAS 轉化細胞的抗增殖作用的能力,將 AMG 410 與泛 RAS 抑制劑區分開來。AMG 410 顯示出強大的臨床前療效,在整個給藥周期內顯著降低磷酸化的 ERK 水平,并在 CDX 和 PDX 模型中實現腫瘤停滯或消退。基于良好的非臨床安全性和有效性,AMG 410 在一系列實體腫瘤適應癥(CRC, PDAC, NSCLC)中的首次人體研究正在計劃中。
(2) AZD0022 (HY-173637): KRASG12D inhibitor
- 原研公司:AstraZeneca
- 適應癥:晚期惡性實體腫瘤
- 臨床狀態:Phase 1/2
AZD0022 是一種強效口服 KRASG12D 選擇性藥物,能夠實現強效抑制 KRASG12D 蛋白的同時保持其膜通透性,從而有利于口服吸收和生物利用度。會議報告了 AZD0022 單藥治療的體內療效。口服給藥劑量依賴性抑制多種 CDX 和 PDX KRASG12D 模型中的腫瘤生長。在結直腸癌、胰腺導管腺癌和非小細胞肺癌模型中,150 mg/kg 每日一次或每日兩次口服劑量可使腫瘤停滯或消退。AZD0022 在小鼠中的有效劑量范圍內耐受性良好。目前 AZD0022 正在進行第一項人體 I/IIa 期研究 (ALAFOSS-01)。
(3) GSK4418959 (HY-169422): WRN Helicase inhibitor
- 原研公司:GSK/IDEAYA
- 適應癥:MSI-H 實體瘤
- 臨床狀態:Phase 1/2
IDE275 (GSK959)是由 IDEAYA 和 GSK 合作開發。臨床前研究表明,IDE275 具有作為 Best-in-class WRN 抑制劑的潛力。IDE275 通過獨特地結合 WRN 的解旋酶結構域,在 MSI-H 模型中提供有效的選擇性抑制,可在子宮內膜癌、結直腸癌和胃癌的MSI-H PDX 和 CDX 模型中誘導單藥腫瘤消退。
GSK 在 2025 年 AACR 年會上聯合展示的臨床前數據凸顯了該分子對治療 MSI-H 實體瘤的選擇性,以及作為單藥治療以及與 PD1 聯合治療進行臨床開發的潛力。據報道,MSI-H 在子宮內膜癌、結直腸癌和胃癌中的患病率分別約為 31%、20% 和 19%。
降解劑:PROTAC & 分子膠
(1) GDC-2992 (HY-156751A): Protac AR degrader
- 原研公司:Genentech
- 適應癥:轉移性去勢抵抗性前列腺癌 (mCRPC)
- 臨床狀態:Phase 1
GDC-2992 (RO7656594) 是一種強效、口服生物利用度高的異雙功能分子,它通過結合 AR 和 E3 泛素連接酶 cereblon (CRBN) 來抑制 AR 信號傳導,從而導致 AR 泛素化并隨后降解。
與已批準或處于臨床階段的 AR 藥物不同,GDC-2992 可在靶內耐藥和缺乏 AR 激動作用的模型中持續 AR 阻斷。
Genentech 披露:GDC-2992 在體外促進多種 PC 模型中的 AR 降解和抑制。在體內,口服 GDC-2992 可產生強大的劑量依賴性療效并抑制循環 PSA。在 AR 報告基因檢測中,GDC-2992 對 AR 變異體表現出廣泛的抑制潛力,但沒有明顯 AR 激動作用。通過提供更全面、更持久的 AR 抑制,GDC-2992 有望降低前列腺癌治療耐藥性和疾病復發的發生率。
(2) BMS-986449 (HY-173630): Molecular glue degrader of Helios & Eos.
- 原研公司:Bristol-Myers Squibb
- 適應癥:非小細胞肺癌和三陰性乳腺癌在內的晚期實體瘤
- 臨床狀態:Phase 1/2
BMS-986449 對 IKZF2 DC50 為 7.6 nM, Dmax 96%, 并且在任何細胞系中均未觀察到 IKZF1 或 IKZF3 的降解 。在攜帶腫瘤的 hCRBN-KI 小鼠中,BMS-986449 每日給藥在 CT26、MB49 和 MC38 腫瘤模型中誘導了單藥治療活性,TGI 值分別高達 75%、62% 和 42%;與抗 PD-1 免疫檢查點阻斷聯合使用時,療效更佳,TGI 值分別高達 95%、97% 和 92%。在食蟹猴中,每日服用 BMS-986449 (0.1 mg/kg) 可維持循環 Treg 細胞中 Helios 降解率超過 80%. BMS-986449 針對晚期實體瘤患者的 1/2 期臨床試驗正持續推進中。
抗體藥
(1) RO7567132: FAP-LTBR bispecific mAb
- 原研公司:Roche
- 適應癥:晚期實體瘤
- 臨床狀態:Phase 1
RO7567132 是一種新型雙特異性抗體,可與淋巴毒素 β 受體 (LTBR) 雙價結合,并與成纖維細胞活化蛋白 (FAP) 單價結合,以此將 LTBR 活化特異性地限制在腫瘤微環境中,并誘導腫瘤部位特異性形成三級淋巴結構 (TLS),同時避免廣泛的 LTBR 活化并最大限度地降低毒性。RO7567132 的鼠源替代物治療可抑制乳腺癌腫瘤生長,并且與阿特珠單抗的鼠源替代物聯合使用時顯示出更高的療效。而在生長緩慢的原位小鼠結直腸癌模型中,RO7567132 的鼠源替代物治療可增加腫瘤中免疫細胞和 HEV 的含量,并誘導類似 TLS 的免疫細胞微環境的形成。
目前,RO7567132 作為單藥以及與阿特珠單抗聯合治療晚期和/或轉移性實體瘤患者的 1 期臨床試驗正持續推進中。
(2) BAY 3547926: Targeted radionuclide therapy
- 原研公司:Bayer
- 適應癥:晚期肝癌
- 臨床狀態:Phase 1
BAY 3547926 是一種靶向 α 放射性藥物,使用腫瘤抗原靶向部分將 α 粒子有效載荷特異性地遞送至病變部位,從而誘導難以修復的聚集性 DNA 雙鏈斷裂。225Ac-GPC3 是一種新型靶向 GPC3 高親和力抗體,與 Macropa 螯合劑結合,可與 225Ac 進行有效穩定的放射性標記,并在體內外誘導腫瘤完全消退。
目前,1 期臨床試驗 BANTAM-01 (NCT06764316) 正在進行中,正在招募 GPC3 陽性的肝細胞癌 (HCC) 患者。
(3) M0324: MUC-1 conditional CD40 agonist
- 原研公司:Merck
- 適應癥:MUC-1 過表達腫瘤
- 臨床狀態:臨床前
M0324 是一種新型 MUC-1 條件性 CD40 激動劑,由抗 MUC-1 IgG 和兩個相同的駱駝重鏈可變結構域 (VHH) 結合 CD40 組成,旨在在 MUC-1 過表達的腫瘤細胞存在的情況下條件性激活免疫細胞。
Merck 披露單劑量單藥 M0324m 治療在兩種不同的免疫功能正常的小鼠腫瘤模型中均表現出強大的腫瘤根除效果 (原位 Panc02-MUC-1 模型中 93% 的小鼠無瘤,MC38-MUC-1 模型中 100% 的小鼠無瘤),并表示 M0324 的條件性作用模式利用腫瘤中 MUC-1 的高表達來誘導靶向抗腫瘤免疫,有望克服傳統 CD40 激動劑的安全局限性。
Section.02
其他熱點關注
ADC 藥物: 靶點創新與療效升級
抗體偶聯藥物 (ADC) 仍是本屆會議的最大焦點,CDH17、CLDN18.2、B7-H3 等靶點競爭激烈,技術平臺迭代推動療效提升。CDH17 作為鈣粘蛋白家族成員,是消化道腫瘤的“黃金靶點”,在肝癌、胃癌、結直腸癌等消化道腫瘤中高表達,且在正常組織中分布受限,成為 ADC 開發的理想靶點。
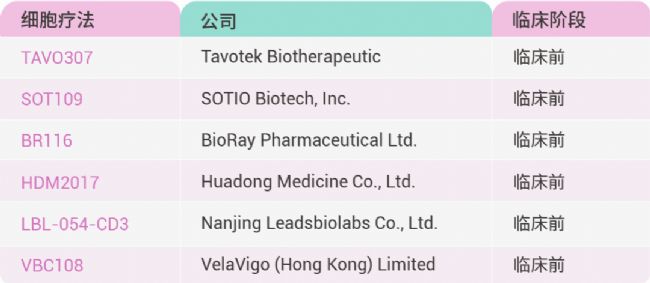
表 1. 會議部分 CDH17 靶點的 ADC 藥物。
免疫療法: CAR-T 細胞療法閃耀登場
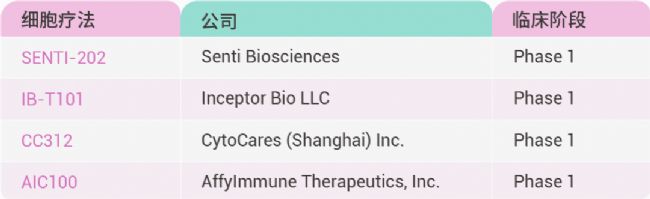
近年來,CAR-T 細胞療法徹底改變了某些 B 細胞惡性腫瘤的治療,為多發性骨髓瘤以及某些類型的白血病和淋巴瘤等疾病帶來了顯著的生存獲益。會議探討了 T 細胞療法療效和擴大其應用范圍的前沿策略,披露了 SENTI-202、IB-T101 等多個細胞療法臨床數據。
表 2. 會議部分細胞療法報道。
Section.03
小結
AACR 年會是全球腫瘤研究的風向標。本次 AACR 會議議題眾多,包括癌癥進化、創新技術、癌癥生態系統靶向、預測腫瘤學等,揭示了多項突破性進展。CDH17 等多個靶點的崛起,以及 First-in-class 藥物的涌現,標志著腫瘤治療進入多維創新時代。未來,跨學科合作與技術創新將進一步推動癌癥治療的精準化與個體化。
Section.04
MCE 風采




|
產品推薦 |
|
一種具有口服活性和腦滲透性的突變選擇性三重復合物 RASG12V 的抑制劑,具有抗腫瘤活性。 |
|
是一種靶向成纖維細胞活化蛋白 (FAP) 的配體。Unlabeled FXX489 可以用 68Ga 和 177Lu 標記,并表現出抗癌作用。 |
|
一種非共價選擇性泛 KRAS 抑制劑,對 KRAS G12D、KRAS G12V 和 KRAS G13D 的 IC50 值為 1-4 nM。 |
|
一種選擇性具有口服活性的 KRASG12D 抑制劑。AZD0022 在 GP2D 異種移植模型中可抑制 KRAS 通路抑制。 |
|
一種非共價、可逆、選擇性且具有口服活性的 WRN 解旋酶抑制劑。 |
|
一種具有口服活性的雄激素受體 (AR) 降解劑。 |
|
一種 CELMoD 分子膠 (molecular glue),是一種 IKZF2/IKZF4 的降解劑。 |
|
Br-Val-Ala-NH2-bicyclo[1.1.1]pentane-7-MAD-MDCPT ADC 分子 ABBV-969 的 drug-linker 部分。 |
參考文獻
[1] Zhe Chen, et al; Abstract 3340: RMC-5127, a first-in-class, orally bioavailable mutant-selective RASG12V(ON) inhibitor is central nervous system (CNS)-penetrant and demonstrates anti-tumor activity in a preclinical intracranial xenograft model. Cancer Res 15 March 2024; 84 (6_Supplement): 3340.
[2] Berger, R. et al. 1660TiP First-in-human study of ABBV-969, a dual variable antibody-drug conjugate (ADC), in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC). Annals of Oncology, Volume 35, S1000 - S1001.
[3] https://www.novartis.com/clinicaltrials/study/nct06562192
[4] https://investor.abpro.co/news-releases/news-release-details/abpro-and-celltrion-unveil-preclinical-data-abp-102ct-p72-aacr
[5] Brian A. Lanman et al, AMG 410: An H/NRAS-sparing pan-KRAS inhibitor with dual GTP(on)/GDP(off)-state activity for the treatment of diverse KRAS-mutant tumors [abstract]. In: Proceedings of the 116th Annual Meeting of the American Association for Cancer Research;2025 April 25-30; Chicago, IL.: AACR; 2025. Abstract nr DDT01.
[6] Kevin Beaumont, et al. The preclinical pharmacokinetics and pharmacodynamics of AZD0022: A potent, oral KRASG12D-selective agent exhibiting oral bioavailability and KRAS pathway suppression in the GP2D xenograft model [abstract]. In: Proceedings of the 116th Annual Meeting of the American Association for Cancer Research;2025 April 25-30; Chicago, IL.: AACR; 2025. Abstract nr 841 / 29.
[7] https://ir.ideayabio.com/2025-03-26-IDEAYA-Announces-Oral-Presentation-at-the-New-Drugs-on-the-Horizon-Series-at-AACR-2025-for-IDE275-GSK959-,-a-Phase-1-Werner-Helicase-Inhibitor
[8] Ciara Metcalfe, et al. GDC-2992: A heterobifunctional Androgen Receptor (AR) antagonist and degrader for the treatment of AR wild-type and mutant prostate cancer. In: Proceedings of the 116th Annual Meeting of the American Association for Cancer Research;2025 April 25-30; Chicago, IL.: AACR; 2025. Abstract nr ND02
[9] Michael J. Barnes, et al. Selective degradation of Helios induces Treg cell reprogramming and enhanced antitumor immunity. In: Proceedings of the 116th Annual Meeting of the American Association for Cancer Research;2025 April 25-30; Chicago, IL.: AACR; 2025. Abstract nr 2249/20
[10] Roberta Bianchi, et al. FAP-LTBR (RO7567132): A first-in-class bi-specific stromal immunomodulatory agonist designed to enable and enhance efficacy of cancer immunotherapies. In: Proceedings of the 116th Annual Meeting of the American Association for Cancer Research;2025 April 25-30; Chicago, IL.: AACR; 2025. Abstract nr ND08
[11] Jenny Karlsson, et al. BAY 3547926: Novel targeted radionuclide therapy for hepatocellular carcinoma. In: Proceedings of the 116th Annual Meeting of the American Association for Cancer Research;2025 April 25-30; Chicago, IL.: AACR; 2025. Abstract nr ND09
[12] Weixiao Sha, et al. M0324, a novel MUC-1 conditional CD40 agonist for selective immune activation in MUC-1 overexpressing tumors. In: Proceedings of the 116th Annual Meeting of the American Association for Cancer Research;2025 April 25-30; Chicago, IL.: AACR; 2025. Abstract nr ND12
- 踏浪前行,雙展收官——知楚四月海外展會圓滿落幕
- 柏恒科技攜定量PCR儀等多款儀器亮相俄羅斯實驗室展
- 慧榮和成功參展俄羅斯國際實驗室設備及化學試劑展
- 慧榮和亮相越南國際分析生化博覽會Analytica 2025
- MCE中國將攜試劑產品亮相美國芝加哥2025 AACR年會
- LAB VIETNAM 2025首屆越南實驗室展通知
- 2026第24屆俄羅斯國際實驗室儀器及設備展覽會通知
- PITTCON 2026美國匹茲堡實驗室分析儀器展通知
- 慧榮和科技成功參展SOT&ToxExpo 2025美國毒理大會
- VIETLAB EXPO 2025越南實驗儀器、分析檢測展通知
- PAKLAB EXPO 2025年巴基斯坦實驗室展通知
- 奧盛攜自動化光學檢測產品亮相Medlab Middle East
- Analytica 2026德國慕尼黑分析生化博覽會通知
- 新年首展,雅睿生物精彩亮相Medlab Middle East
- 天隆科技攜創新產品精彩亮相迪拜2025 Medlab展會
- 2025AACR年會圓滿落幕,MCE攜試劑產品亮相芝加哥
- 西美杰成功參加第十屆生物制藥穩定性論壇
- 投稿有禮-2025 MCE中國生命科學研究促進獎正式啟動
- 艾偉拓&安拓思會議邀請:集采時代的復雜制劑新方向
- 開學季,科研福利到!本生生物提取試劑盒限時特惠
- 西安百螢生物酪胺染料限時促銷,購買即免費送電影票
- 美德聲推出通過LC-MS/MS擴大新生兒篩查的檢測試劑
- 西美杰正式推出USP/EP標準品采購服務
- 中國生物化學與分子生物學會2025全國學術大會招商函
- MCE推出生命科學文獻有投必獎活動(腫瘤與癌癥)
- 睿通生物推出新品ML19熔融石英折射率匹配液
- MCE直播:同位素標記物示蹤劑與定量內標品的探索
- MCE邀您參加2024年滿意度有獎調查&感恩節回饋活動
- MCE暖冬鉅惠:染料、siRNA65折,享1.5倍牌價積分
- MCE中國11月展會預告: 蘇州生物藥創新開發峰會等






